下列关于电解质溶液的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| B.在0.1mol·L-1的NaHA溶液pH=4,则H2A为强酸 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 |
| D.向0.1mol·L-1的氨水中加少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
B.如图可表示由CO生成CO2的反应过程和能量关系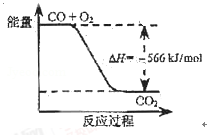 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol HI(a>b),可逆反应2HI  H2+I2(g)达到平衡后,下列说法正确的是
H2+I2(g)达到平衡后,下列说法正确的是
A.开始时A容器中的反应速率大于B容器中的反应速率
B.平衡时c(I2)A=c(I2)B
C. HI的平衡分解率:αA>αB
D.平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器
在密闭定容容器中,有可逆反应:nA(g)+mB(g) pC(g)+qD(g)ΔH>0处于平衡状态(已知m+n>p+q),下列说法正确的是
pC(g)+qD(g)ΔH>0处于平衡状态(已知m+n>p+q),下列说法正确的是
①升温时C(B)/C(C)的值减小
②降温时,体系内混合气体的平均相对分子质量增大
③加入B后,A的转化率变大
A.①②③ B.②③ C.①② D.①③
用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而减小的是
A.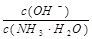 |
B. |
| C.c(H+)和c(OH-)的乘积 |
| D.OH-的物质的量 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.25℃时,pH=3的1.0 L NaHSO3溶液中,含Na+数目为0.001NA |
| B.常温下,1L pH=12的Ba(OH)2溶液中含OH—的数目为2NA |
| C.1L0.1mol·L—1的氨水中含有的NH3分子数小于0.1 NA |
| D.在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA |