某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验: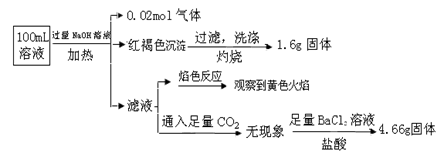
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是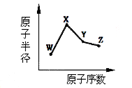
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B.0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C.足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D.常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
下列表示化学反应的离子方程式正确的是
| A.Na2O2与水反应:Na2O2 + H2O = 2Na+ + 2OH- + O2↑ |
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
| D.硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O |
下列离子在给定的条件下一定能大量共存的是
| A.加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3— |
| B.c(Fe3+)=0.1mol/L的溶液中:NH4+、Cl—、AlO2—、SO42— |
| C.水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3—、Cl— |
| D.含有SCN—离子的溶液中:Ca2+、Fe2+、NO3—、Cl— |
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
| A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 |
| B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
| C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 |
| D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |