我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是( )
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下).
(8分)判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
| 次氯酸 |
磷酸 |
硫酸 |
高氯酸 |
|
| 含氧酸 |
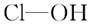 |
 |
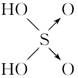 |
 |
| 非羟基 氧原子数 |
0 |
1 |
2 |
3 |
| 酸性 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:
亚磷酸_____________________________________________,
亚砷酸_______________________________________。
(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式。
亚磷酸:___________________________________________,
亚砷酸:________________________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,可以反应的用化学方程式表示。
亚磷酸:__________________________________________________
亚砷酸_________________________________________________。
(11分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是_____,b的结构式是_______;中心原子的杂化轨道类型分别是________、_________;a分子的立体结构是____________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体;
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式);
(4)Y与Z比较,电负性较大的是____________;
(5)W的元素符号是,其+2价离子的核外电子排布式是
(12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、B、C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是,由非极性键形成的非极性分子是,能形成分子晶体的化合物是,含有氢键的晶体的化学式,属于原子晶体的是,四种物质熔点由高到低的顺序是。
河道旁有甲、乙两厂。它们排放废水中含K+、Ag+、Fe3+、C1-、OH-、NO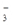 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是、、。
(2)乙厂的废水中含有另外三种离子。如果加一定量(选填“活性炭”“铁粉”),可以回收其中的。
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
H++MnO4-+H2C2O4→CO2↑+Mn2++
(1)配平以上离子方程式,并在□中填上所需的微粒。(2)该反应中的还原剂是。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为mol。