医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
H++ MnO4- + H2C2O4→ CO2↑+ Mn2++ 
(1)配平以上离子方程式,并在□中填上所需的微粒。(2)该反应中的还原剂是 。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
α,β不饱和化合物在有机合成中有着广泛的用途。反应①是合成α,β不饱和化合物的常见的方法。
反应①:
(1)化合物Ⅰ的分子式为,1mol化合物Ⅰ最多能与 molH2发生加成反应。
(2)下列说法,正确的是。
| A.反应①属于加成反应 |
| B.化合物Ⅰ遇氯化铁溶液显紫色 |
| C.化合物Ⅰ能与NaHCO3反应 |
| D.化合物Ⅲ与Br2既能发生取代反应,也能发生加成反应 |
(3)化合物Ⅳ可以通过化合物Ⅲ在一定条件下发生分子内的酯化得到;请写出该反应的化学方程式(注明必要的条件),化合物Ⅴ是化合物Ⅳ的同分异构体,也是具有两个六元环的酯。化合物Ⅴ的结构简式为。
(4) 也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为。在工业上化合物Ⅱ可以通过CH3CHO制备,请仅以乙烯为有机物原料两步合成CH3CHO,涉及的反应方程式为(注明必要的条件)
也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为。在工业上化合物Ⅱ可以通过CH3CHO制备,请仅以乙烯为有机物原料两步合成CH3CHO,涉及的反应方程式为(注明必要的条件)
①;②。
(12分) 2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有。
a.C2H4是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为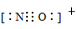
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶
①V2+基态时核外电子排布式为。
②熔融空气电池钒硼晶体晶胞结构如右图1所示,该晶胞中含有钒原子数目为。
(3)烟酰胺结构式如右图2所示,可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有,1mol该分子中含σ键数目为。
(4)配离子[Cu(NH3)4]2+中N原子是配位原子。已知NF3与NH3的空间构型相同,但NF3中N不易与Cu2+形成配离子,其原因是。
(6分)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余的Cr3+的物质的量浓度为mol·L-1(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2 S2O3标准溶液,终点时消耗Na2 S2O3溶液20.00 ml。计算废水中铬元素总浓度mg·L-l
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,平衡后则溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: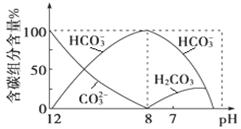
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、,溶液中含量最多的三种微粒的物质的量浓度的大小关系为;
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh =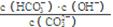 =2×10-4 mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=。
=2×10-4 mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=。
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g) C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(C8H10)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(C8H8)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是______。
(2)该温度下,该反应的化学平衡常数是_______________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且该反应(填序号①“向生成C8H10方向移动”、②“向生成H2方向移动”或③“平衡不移动”)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
D、T℃时,当c(C8H10):c(C8H8):c(H2)=1:1:1反应达到平衡。