苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g) C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
C8H8(g)+H2(g) ΔH=+120 kJ·mol-1温度T℃下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(C8H10)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(C8H8)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是______。
(2)该温度下,该反应的化学平衡常数是_______________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且该反应 (填序号①“向生成C8H10方向移动”、②“向生成H2方向移动”或③“平衡不移动”)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
D、T℃时,当c(C8H10):c(C8H8):c(H2)=1:1:1反应达到平衡。
15分)(1)下图所示的模型表示的分子中,可由碳和氢两种元素形成的是。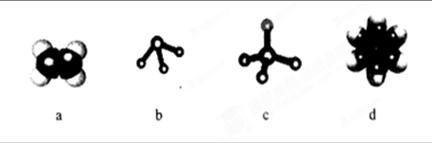
c分子的空间构型为;d分子的结构简式
(2)关于a分子有下列问题:
①如果a分子中的一个氢原子被甲基取代后得到的物质中在同一平面的原子最多有____________个。
②a能使溴的水溶液褪色,该反应的生成物的名称是。
③a与氢气发生加成反应后生成分子e,e在分子组成和结构上相似的有机物有一大类(又称“同系物”),它们均符合通式CnH2n+2,当n=_______时,这类有机物开始出现同分异构体,写出该烷烃可能有的同分异构体结构简式。
(3)苯环结构中,不存在单双键交替结构,可以作为证据的事实是:①苯不能使KMnO4(H+)溶液褪色②苯中碳碳键的键长均相等③苯能在一定条件下跟H2发生加成反应生成环己烷④经实验测得邻二甲苯仅有一种结构⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不能因化学变化而使溴水褪色。其中正确的是
(4)已知乳酸的结构简式为CH3CH(OH)COOH。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与金属钠反应的化学方程式为
_________________________________________________________________;
③当乳酸和浓硫酸共热时,能产生多种酯类化合物,写出乳酸在一定条件下合成聚酯的化学方程式_________________________________________________________________
下表是元素周期表的一部分,回答下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||
| 2 |
① |
② |
||||||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||||
| 4 |
⑩ |

|
|
⑴.在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同) ,碱性最强的是 ,呈两性的氢氧化物是 ,
⑵.写出工业上冶炼⑤的化学方程式为 ;⑤与一种黑色晶体反应冶炼铁的化学方程式为: 。
⑶.在⑧与⑦中,非金属性较强的元素是 ,写出可以验证该结论的一个离子反应方程式 。
分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________;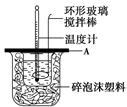
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
| A.反应前盐酸溶液的温度 |
| B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 |
| D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
地球上的资源是有限的,要合理的开发和利用。海水化学资源的利用具有非常广泛的前景。
I.下列有关海水综合利用的说法中,正确的是()
A.海水中含有钾元素,只需经过物理变化就可以得到金属钾
B.用蒸馏、电渗析、离子交换等方法能从海水中提取淡水
C.从海水中可以得到氯化钠,电解熔融氯化钠可制取金属钠
D.利用潮汐发电是将化学能转化为电能
II.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: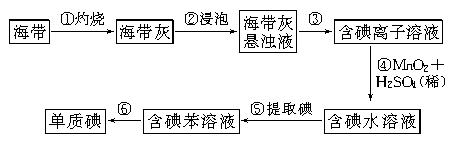
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器 G.坩埚钳
(2)步骤③⑤的实验操作名称分别是______;,步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤④反应的离子方程式是____________________________________________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
________________________________________________________________________
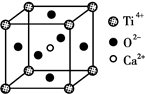
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是_______________。
C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是________________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 每个COCl2分子内含有个δ键,个π键。其中心原子采取杂化轨道方式。
每个COCl2分子内含有个δ键,个π键。其中心原子采取杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是_______________。
(3)CaTiO3晶体中(晶胞结构如图所示),Ti4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______;