在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,平衡后则溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式: 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式: 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: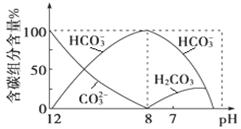
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh =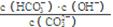 =2×10-4 mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= 。
=2×10-4 mol/L,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= 。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳2制取漂白粉,化学反应方程式为__________________________。
(2)漂白粉的有效成分是(填化学式)____________________。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应
方程式为____________________________________________________。
(4)(1)和(3)的反应中,属于氧化还原反应的是(填编号)_________________________。
根据硫酸及其盐的性质回答下列问题。
(1)将适量的蔗糖放入一烧杯中,再加入浓硫酸,观察到蔗糖变黑,体积膨胀,并产生刺激性气味的气体。生成的黑色物质是__________(填化学式);刺激性气味的气体主要成分是_________(填化学式);该实验表明浓硫酸具有性、性。
(2) “绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)。
(1)0.7 mol H2O的质量为____________,其中含有_________个水分子,氢原子的物质的量为__________。
(2)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(3)在_______mL 0.2 mo1·L-1 NaOH溶液(密度为1 g·cm-3)中含1g溶质;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O__________g。
在HCl、Cl2、O2、NH3、NO2、CO2、H2、SO2等中,
(1)不能用浓硫酸干燥的气体有_____________________________;
(2)酸雨主要有________________________气体造成的;
(3)比空气轻的气体有___________________________;
(4)用水作溶剂,可进行喷泉实验的气体有_________________;
(5)能用碱石灰干燥的气体有__________________________________;
(6)能使品红溶液褪色的气体有________________________________;
(7)可导致光化学烟雾的气体有________________________________。
硫酸是一种常见的强酸,你能写出稀硫酸与下列物质反应的离子方程式。
(1)铁________________________________________________________;
(2)氧化铜______________________________________________________;
(3)碳酸钠________________________________________________________;
(4)氢氧化钡溶液___________________________________________________;
(5)氯化钡溶液____________________________________________________。