A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)A与B形成的化合物中,原子个数比为2:1的化合物的结构式为 。
(2)D与C按原子个数比为1:1形成化合物的电子式是 。
(3)B、C所形成氢化物的稳定性由强到弱的顺序是 、 (填具体的化学式)。
(4)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的一种化合物反应的离子方程式: 。
(5)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(6)E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,则△Hl △H2(填“>”或“<”或“=”)。
某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:
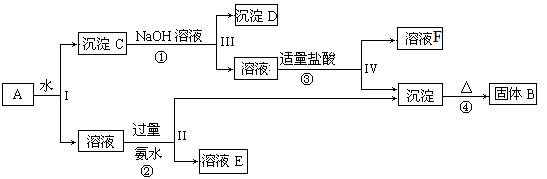
据此回答下列问题:
(1) I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2) 根据上图反应关系,写出下列B、F所含物质成分的化学式:B ; F。
; F。
(3) 写出过程反应①的离子方程式,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式。
(4)写出③中盐酸过量时的离子反应方程式  。
。
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol・L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol・L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下 列填空:
列填空:
(1)在实验1,反应在10 min至20 min时间内平均速率为mol・L-1・min-1
(2)在实验2,A的初始浓度C2=mol・L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验 3的反应速率为V3,实验1的反应速率为V1,则V3V1(选填“>”、“=”、“<”),且C31.0 mol・L-1(选填“>”、“=”、“<”)。
3的反应速率为V3,实验1的反应速率为V1,则V3V1(选填“>”、“=”、“<”),且C31.0 mol・L-1(选填“>”、“=”、“<”)。
(4)比较实验4和实验1,可 推测该反应是________反应(选填“吸热”或“放热”)。理由是__________。
推测该反应是________反应(选填“吸热”或“放热”)。理由是__________。
(6分)将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况(填写金属或金属离子,用化学符号表示)。
(1) 充分反应后,如果Fe有剩余,则容器内不可能有;
(2) 充分反应后,如果容器内还有大量Fe3+,不可能有;
(3) 充分反应后,如果容器内有较多Cu2+和较多的Cu,则容器内不可能有。
完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □,
该反应中氧化剂是,当生成2mol NO时,转移的电子数为NA。
氨分子的结构是型;实验室制取氨气的化学方程式为,检验氨气是否收集满的常用方法是。