为了分离甲醇、甲酸、苯、苯酚的混合物,有人设计了下列实验过程。请在括号内填写分离时所用操作方法,并写出方框内有关物质的结构简式。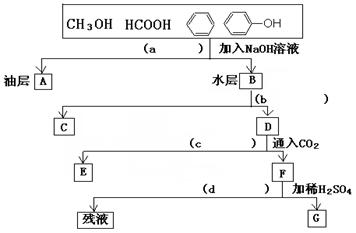
写出下列物质的结构简式A 、C 、
E 、G 。
某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
请回答下列问题:
①所加入的试剂分别是
A________,B________,C________;
②加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
(10分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
<实验课题>废旧聚丙烯塑料热分解主要产物为烃的探究
<查阅资料>
①废旧聚丙烯塑料热分解的产物为常温下的气态烃和液态烃,且不含一氧化碳和氢气
②CuO能将烃氧化成CO2和H2O
③甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯
<实验设计>
<实验记录>
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E中黑色氧化铜变红;④F中无水硫酸铜变蓝。
<问题讨论>
请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要将两者分离,其实验方法是;若要除去混合物中的甲苯,其方法是向混合物中加入足量酸性KMnO4溶液,充分反应后,再加入一定量的NaOH溶液,充分反应,再。
(2)C装置的作用是;如果没有D装置,对实验结论产生的影响是。
(3)若需验证聚丙烯塑料热分解产物中确含气态烃,还需在F装置后增加一个实验装置,请将增加的装置图(要注明其中盛放的试剂名称)画在“实验设计”栏中的空白方框内。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(1)实验操作③的名称是___________,所用主要仪器名称为______________________。
(2)提取碘的过程中,可选择的试剂是________________(已知碘的沸点为184.40C)。
A.酒精(沸点780C) B.四氯化碳(沸点770C)
C.甘油(沸点1900C) D.苯(沸点800C)
(3)操作②的离子方程式为;该步骤的含I2溶液中生成有少量ICl,为使碘全部以单质形式游离出来,应加入适量KI溶液,此反应的化学方程式为。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验 编号 |
温度 (℃) |
大理石 规格 |
HNO3浓度(mol/L) |
实验目的 |
| ① |
25 |
粗颗粒 |
2.00 |
(I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究对反应速率的影响 |
| ② |
25 |
粗颗粒 |
||
| ③ |
粗颗粒 |
2.00 |
||
| ④ |
25 |
细颗粒 |
2.00 |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HNO3/*-表示的平均反应速率(忽略溶液体积变化,不需要写出计算过程)。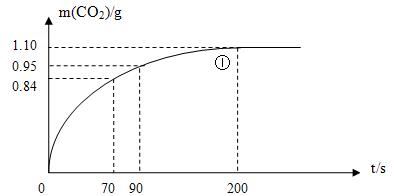
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/L H2SO4(mL) |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液(mL) |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O(mL) |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________________________________________________________________________________________。