哈佛大学教授Elias James Corey因提出“逆合成分析原理”,将有机合成路线设计技巧艺术的变成了严格的思维逻辑科学而获得1990年诺贝尔化学奖。逆合成分析法可示意如下:
下图是某同学运用逆合成分析法分析合成二乙酸-1,4-环己二醇酯的中间体和基础原料的示意图,请回答有关问题: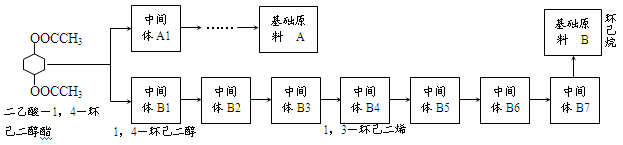
(1)基础原料A的电子式为 。由A到A1,最少经过 步反应。
(2)写出下列物质转化时的反应条件和反应类型:
①B→B7。反应条件: ,反应类型 ;
②B7→B6。反应条件: ,反应类型 。
(3)写出下列反应的化学方程式,注明反应条件:
①B5→B4: ;
②B3→B2: 。
已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。
“物质结构与性质”
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于晶体。
(2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有的原子或离子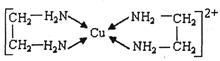
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是。
②SO2分子的空间构型为。与SnCl4互为等电子体的一种离子的化学式为。
③乙二胺分子中氮原子轨道的杂化类型为。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
④⑶中所形成的配离子中含有的化学键类型有。
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为。
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 |
Ksp |
| Ca3(AsO4)2 |
6.8×10-19 |
| AlAsO4 |
1.6×10-16 |
| FeAsO4 |
5.7×10-21 |
| 污染物 |
H2SO4 |
As |
| 浓度 |
28.42 g/L |
1.6 g·L-1 |
| 排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表1.几种砷酸盐的Ksp表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)最大的是mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为。
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释)。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是。
②b中,生成Li2CO3反应的化学方程式是。
非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是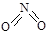 和
和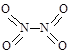 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2 (g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4(g)该反应的平衡常数K的值为;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)