I.利用含锰废水(主要含Mn2+、SO 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH如下表:
回答下列问题:
(1)过程②中,所得滤渣的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表:
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN B.HC1O C.C6H5OH D.CH3 COOH E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
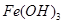 |
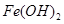 |
 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。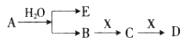
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。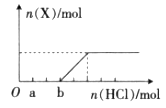
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的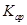 =2.5×
=2.5×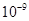 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·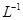 的BaCl2溶液中,其
的BaCl2溶液中,其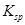 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·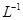 。
。
随着对有机高性能纤维的不断深入研究,美国已开发出一种超高性能纤维,该纤维不仅具有PBO纤维的抗张性能,而且还有优于PBO纤维的抗压缩性能。下面是以对二甲苯为原料合成该纤维的合成路线(有些反应未注条件)。请回答: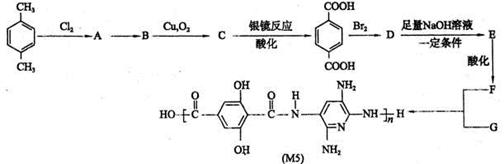
(1)写出合成该纤维的单体F的结构简式:。
(2)反应类型:A→B,B→C。
(3)写出化学方程式(注明反应条件):
B→C; D→E。
(4)若1molF与足量Na2CO3溶液完全反应,则消耗Na2CO3mol
(5)写出两种符合下列条件物质的结构简式:、。
①与B互为同分异构体②遇FeCl3溶液有显色反应
③核磁共振氢谱有3组峰,且峰面积之比为3:1:1。
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为______;
(3)Se原子序数为______,其核外M层电子的排布式为______;
(4)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______平面三角形,SO32-离子的立体构型为______三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98. 5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。