利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质。用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去得无色溶液。据此回答: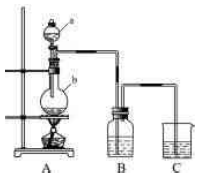
(1)仪器b的名称为 ,b中发生反应的离子方程式为 。
(2)如何检验A装置的气密性
(3)氯水长时间放置,pH将会
(4)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去。② 。
(5)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
【实验步骤】
①取上述实验后试管内的无色溶液3 mL盛于另一支洁净的试管中;② ,振荡试管。
【现象与结论】
①若 ,则证明溶液红色褪去的原因是①而不是②。
②若 ,则证明溶液红色褪去的原因是②而不是①。
(6)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是 。
| A.CaCO3 | B.NaHSO3 | C.饱和 NaCl溶液 | D.Ca(OH)2 |
(7)有人提议本实验AB之间要加一个盛有饱和食盐水的除杂装置,你认为是否有必要(填“是”或“否”)______
(8)本实验有一明显的错误是,改正措施是
如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。请回答:
(1)B极是电源的 极。C电极上的电极反应式: 。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH=13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 。
(4)丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B = H++HB-,HB- H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是 。(用离子方程式表示)
(2)在0.1 mol·L-1 Na2B溶液中,下列粒子浓度关系式正确的是 。
| A.c(Na+)+(OH-)=c(H+)+c(HB-) |
| B.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-) |
| C.c(Na+)=2c(B2-)+2c(HB-) |
| D.c(B2-)+ c(HB-)=0.1mol·L-1 |
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”“>”或”=”),理由是 。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
按要求书写下列反应的离子方程式
(1)CuSO4溶液与过量Ba(OH)2溶液反应:
(2)Al2(SO4)3溶液中加入过量氨水:
(3)将过量SO2气体通入冷氨水中:
(4)向NaAlO2溶液中通入过量CO2:
(5)0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
亚硫酸钠中+4价的硫,它既有氧化性又有还原性,现在有试剂:溴水、硫化钠溶液,NaOH溶液、氯化钡溶液、稀硫酸。
(1)要证明亚硫酸钠具有还原性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
(2)要证明亚硫酸钠具有氧化性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。