(10分)按要求填空:
(1)2.7 g H2O所含氢原子数与 L(标准状况下)NH3所含氢原子数相等。
(2)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ H2SO4 ⑥Cu
属于电解质的有 (填序号)。
(3)用单线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓)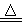 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 。
②如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 L。
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有。
(2)取10.00mL待测液,用式滴定管量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视,直到滴定到终点。
(4)根据下列数据,烧碱的纯度为。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差 (填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视
②用待测液润洗锥形瓶
③ 滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
反应3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
每生成11.2L标准状况下的气体,被还原的(填氧化剂的名称)的质量为 。
(10分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑,此反应中的氧化剂是,还原剂是(均用化学式填写)。当参加反应的S的质量为48g时,爆炸生成的气体折算成标准状况的体积为。氧化还原反应的本质是反应中有电子转移,小明同学对这个重要知识点掌握的不是很理想,他很苦恼。请你写出一个你所熟悉的氧化还原反应的方程式,并标出电子转移的方向和数目,帮助小明同学彻底掌握这个知识点。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.分液 | B.升华 | C.结晶 | D.蒸发 E.蒸馏 F.过滤 |
(1)______分离豆浆与豆渣的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和食用调和油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5)______用海水晒盐。
(6 分)现有下列四种物质:Na2SO4、BaSO4、蔗糖(C12H22O11)、H2SO4,按照一定的依据,能找出一种物质与其它三种物质不同,从而分成两类。请你试试看,一共能找出多少种分法,把分类的依据和结果写在下面的表格中。(填三种即可)
| 与其它三种不同的物质 |
分类依据 |