已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
下列说法中正确的是
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
下列说法正确的是
| A. | 仅用 溶液便可鉴别亚硝酸钠和食盐 |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C. | 乙酸与乙醇的混合溶液可用分液漏斗进行分离 |
| D. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准润洗,则测定结果偏低 |
一种从植物中提取的天然化合物
,可用于制作"香水",其结构为:
 ,
,
有关该化合物的下列说法不正确的是()
| A. |
分子式为
|
| B. |
该化合物可发生聚合反应 |
| C. |
1
该化合物完全燃烧消耗19
|
| D. |
与溴的 溶液反应生成的产物经水解、稀硝酸化后可用 溶液检验 |
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
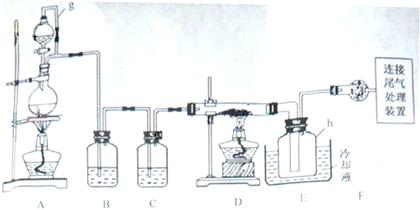
 相关信息如下:
相关信息如下: a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:

 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式 。
(1)写出装置A中发生反应的离子方程式 。 (2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
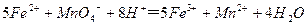
 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
超音速飞机在平流层飞行时,尾气中的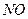 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的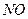 和
和 转变成
转变成 和
和 ,化学方程式如下:
,化学方程式如下:


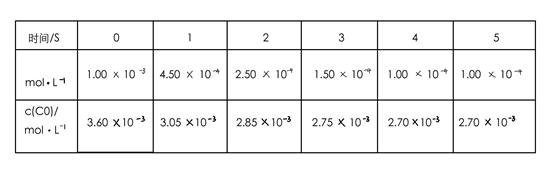
 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响): (1)在上述条件下反应能够自发进行,则反应的
(1)在上述条件下反应能够自发进行,则反应的 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。 (2)前2s内的平均反应速率v(N2)=_____________。
(2)前2s内的平均反应速率v(N2)=_____________。 (3)在该温度下,反应的平衡常数K= 。
(3)在该温度下,反应的平衡常数K= 。 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
| A.选用更有效的催化剂 | B.升高反应体系的温度 |
C.降低反应体系的温度 | D.缩小容器的体积 |
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
已知:25°C时,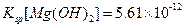 ,
,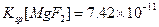 。下列说法正确的是
。下列说法正确的是

A.25°C时,饱和 溶液与饱和 溶液与饱和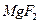 溶液相比,前者的 溶液相比,前者的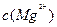 大 大 |
B.25°C时,在 的悬浊液加入少量的 的悬浊液加入少量的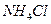 固体, 固体,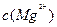 增大 增大 |
C.25°C时, 固体在20ml0.01 mol· 固体在20ml0.01 mol·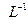 氨水中的 氨水中的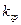 比在20mL0.01mol· 比在20mL0.01mol·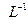 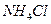 溶液中的 溶液中的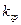 小 小 |
D.25°C时,在 的悬浊液加入 的悬浊液加入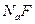 溶液后, 溶液后, 不可能转化成为 不可能转化成为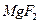 |