某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为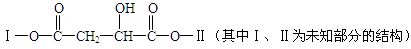
为推测X的分子结构,进行如下图的转化: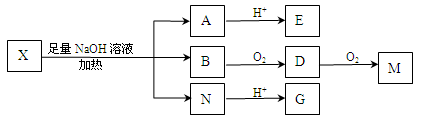
已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。
请回答:
(1)M的结构简式为_____________;G分子所含官能团的名称是______________。
(2)E可以发生的反应有(选填序号)___________。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)由B转化成D的化学方程式是________________________。
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式是__________________。
(5)已知在X分子结构中,I里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是:___________________。
(6)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有________种。
石油主要由烷烃、环烷烃和各种芳香烃组成,石油通过分馏、裂化可得直馏汽油和裂化汽油。现有直馏汽油和裂化汽油各一瓶。
(1)请从下列试剂中选择最合理的试剂予以区别。所选试剂是 。
A.KMn04(H+)溶液B.乙醇C.溴水
(2)加入所选试剂后,直馏汽油中观察到的现象是 ;裂化汽油
中观察得到现象是 。
煤、石油、天然气、水能及生物能等是多年来大规模使用的能源,被称为能源。而核能、地热、海洋能、沼气及现在又有新的利用方式的太阳能、风能等被称为能源。煤、石油、天然气质量分别相等时,哪一种燃料对环境造成的负面影响(产生温室效应)最小? 。
有一套以天然气为燃料的灶具,改用石油气(C3H8)为燃料,使用时应采用的改装措施是 ,其原因是 。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4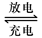 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将__________________。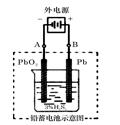
化学电池在通讯、交通及日常生活中有着广泛的应用,目前常用的镍(Ni)镉(Cd)电池,其电池总反应可示为: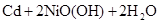

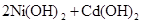
(1)下列有关镍镉电池总反应的说法中,正确的是________(填序号);
①以上反应是可逆反应②以上反应不是可逆反应
③充电时化学能转变为电能④放电时化学能转变为电能
(2)已知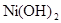 和
和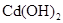 均难溶于水.有资料表明,一节废镍镉电池可以使一平
均难溶于水.有资料表明,一节废镍镉电池可以使一平
方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为___
_____________________________________;
(3)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为: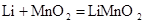 .试回答:①锂电池比容量特别大的原因是_______________________________________;
.试回答:①锂电池比容量特别大的原因是_______________________________________;
②锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_______________________________________.