1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:

(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P的关系如右图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
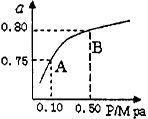
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示)。
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右图所示,

若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液,证明过氧化钠已经变质。
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。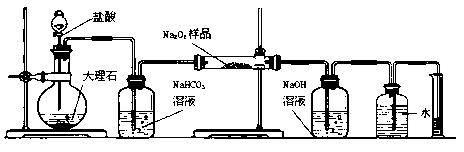
| A. | B. | C. | D.(E)(F) |
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
下列物质之间有如下反应关系: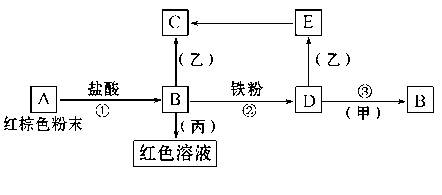
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:甲________,丙________。
(2)写出E→C反应的化学方程式:___________________________。为了获得E,可以用新配制的D溶液与用不含O2的蒸馏水配制的乙溶液反应制备。
(3)用相应晶体配制上述D溶液时你觉得还需加入。
(4)写出Fe与H20在一定条件下反应的化学方程式 。
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)。
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
芳香化合物A、B互为同分异构体,B的结构简式如图所示,A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。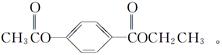
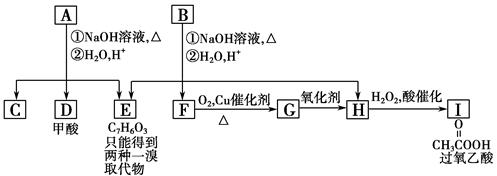
提示:①苯酚既具有酸性,又可与羧酸发生酯化反应。
②酯在NaOH加热的条件下可水解为对应的羧酸钠和醇。
R1COOR2 R1COONa+R2OH
R1COONa+R2OH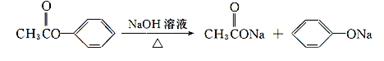
(1)写出E的结构简式____________________________________________________。
(2)A有2种可能的结构,写出相应的结构简式。__________________________________________。
(3)F和小粒金属钠反应的化学方程式是_______________ _______________
(4)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式_ ________。反应类型是____________。
(5)写出F生成G的反应方程式____________________
(6)在B、C、D、F、G、I化合物中,互为同系物的是__________________。