焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表(实验方案与实验现象没对应)
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
请你帮助该同学完成实验报告:
(1)实验的目的。
(2)实验仪器:①②③④试管夹
⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为(填字母编号)。实验现象
(A)为:。
(4)实验结论。
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)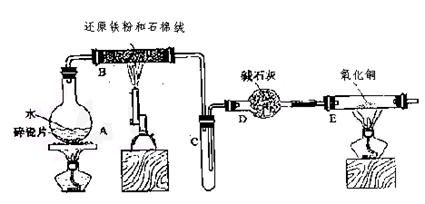
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
此步涉及反应的离子方程式为。
(2)反应发生后装置B中发生反应的化学方程式是。
D装置的作用:。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: 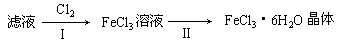
①用离子方程式表示步骤I中通入Cl2的作用②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填“合理”或“不合理”)。
(本题16分)一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是。
a.对A装置加热b.向A内加入少量Fe2O3
c.向A内加入少量CuOd.增大空气通入量
e.向A内加入少量FeSO4f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液; b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:。
(本题16分)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:。
(2)“灼烧”时发生反应的化学方程式:。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:。
(4)副产品X的化学式是:;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为。
(6)检验产品中含有碳酸钠杂质所需试剂是(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸
(本题共16分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: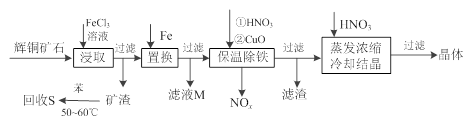
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)写出浸取过程中Cu2S溶解成Cu2+的离子方程式 _________________________。
(2)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为 _______________________________________________________
(3)可向滤液M中加入(或通入)下列 ____(填字母)物质,得到较多的另一种可循环利用的物质。
A.Fe B.NaClO C.H2O2 D. Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是 _______________________。
(5)在除铁阶段,如果pH控制不当会使产量降低。你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为________,充分反应后过滤,将滤液与原滤液合并。