(1)研究硫及其化合物性质有重要意义。
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g)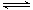 2SO3(g)。
2SO3(g)。
向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。

温度为T1时,反应的平衡常数K= 。(单位必须写)若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变); 在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a.KNO3溶液 b.AlCl3溶液 c.Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为 。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是,名称是。
(2)①的反应类型是,③的反应类型是。
(3)反应④ 的化学方程式是。
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示。已知这个反应的反应速率随溶液中氢离子浓度增大而加快,试解释: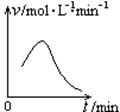
(1)反应开始后,反应速率加快的原因是______________________。
(2)反应后期,反应速率下降的原因是________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:食盐+H2O 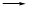 NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐t。
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
写出②④的化学反应方程式:
(5)上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
| A.皂化反应 | B.聚合反应 | C.与金属钠反应 | D.氧化反应 |
由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:;若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g) + 1/2O2(g) = H2O(l) 的ΔH=kJ/mol 。氢气的燃烧热为kJ/mol 。
已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下图中转化关系: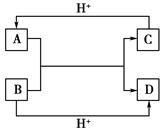
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的化学式________;D的化学式________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式______________。