由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: ;若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g) + 1/2O2(g) = H2O(l) 的ΔH= kJ/mol 。氢气的燃烧热为 kJ/mol 。
(17分)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。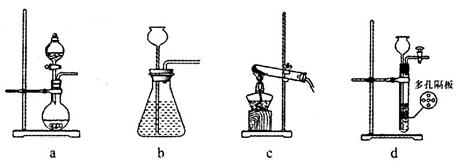
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)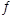 2SO3(g)△H="a" kJ·mol-1
2SO3(g)△H="a" kJ·mol-1
在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为___________________.
选做(12分)【化学——有机化学基础】香豆素是一种天然香料,经常存在于黑香豆、兰花等植物中。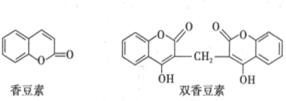
(1)以上是两种常见香豆素,关于香豆素和双香豆素,下列说法正确的是______(填序号)
| A.双香豆素能与FeCl3溶液发生显色反应 |
| B.都属于芳香烃 |
| C.分子中均含有酯基 |
| D.1 mol香豆素含碳碳双键数为4NA (NA为阿伏加德罗常数的值) |
(2)写出香豆素与足量NaOH溶液反应的化学方程式______。
(3)以甲苯为原料生产香豆素流程如下: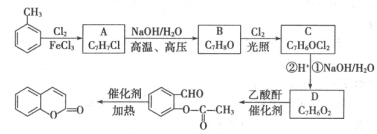
已知:(i)B可与FeCl3溶液发生显色反应;
(ii)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基。
①C的结构简式是______A→B的反应类型是____________
②D与乙酸酐反应 ,除生成
,除生成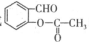 外,另一种产物是____________。
外,另一种产物是____________。
③异香豆素与香豆素互为同分异构体,具有以下特点:
(a)含有苯环;
(b)含有与香豆素相似的两个六元环;
(c)l mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH。
写出异香豆素的结构简式______。
选做【化学——物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为______。
②BH4-的空间构型是________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用 ,实现储氢和输氢。下列说法正确的是________。
,实现储氢和输氢。下列说法正确的是________。
a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+<NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3
上述化学方程式中的5种物质所属的晶体类型有________(填序号)
a.离子晶体b.分子晶体
c.原子晶体d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为________________。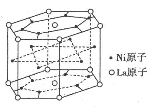
X、Y、Z、W、E五种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。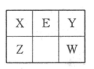
(1)能证明X、Z两元素非金属性强弱的离子方程式为
(2)一定条件下,在恒容容器中,充人一定量的WY2 (g)和XY (g),发生反应: 时,各物质的平衡浓度如下表:
时,各物质的平衡浓度如下表: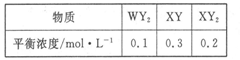
①若温度升高到 T2℃时,反应的平衡常数为6.64,则该反应的逆反应为______反应(填“吸热”或“放热”)。
②其他条件不变,若该反应在恒压条件下进行,平衡时XY的转化率a2______a1(T1℃时的转化率)(填“<”“>”“=”)
(3)室温下,Mg(OH)2饱和溶液______(填“能”或“不能”)使石蕊试液变蓝,通过计算说明原因(已知: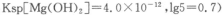 。答
。答
(4)化学反应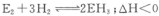 在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是______(填字母代号)
在工业生产中有重要的地位,若要提高E2的转化率,可采取的措施是______(填字母代号)
a.升高温度b.加催化剂c.增加H2的浓度d.分离出EH3
一定条件下,1mol E2与3molH2在密闭容器中反应达到平衡,E2的转化率为25%且放出23.lkJ能量,则该条件下反应的热化学反应方程式为____________________.
(5)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示。其中B为电源的______极,其电极反应式为______。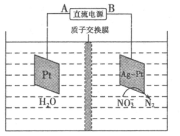
【化学—物质结构与性质】金属及其合金应用广泛。
(1)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是___________________。
(2)下图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b点对应的元素为______(填元素符号)。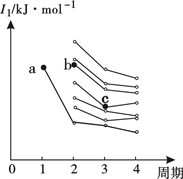
(3)乙醇可被三氧化铬(CrO3)氧化为乙醛(CH3CHO)。乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是_____________________。
(4)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是。
(5)元素Al与元素Fe形成某种晶体结构如图所示。若晶胞的边长为a nm,则合金的密度为_______g·cm—3。