在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。

(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确? (填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
(2)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)(填“>”、“<”或“=”)。
(3)在C点,溶液中离子浓度由大到小的顺序为: 。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下: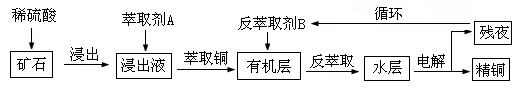
已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:。
(2)写出用惰性电极电解水层的电解总反应方程式:。
(3)循环中反萃取剂B的主要成分是。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol•L—1H2SO4溶液浸取后,还需加入10mL 1.0mol•L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
药物G是一种抗精神病药物,一种工业合成G的路线如下:
(1)有机物B中含氧官能团有、及羟基(填官能团名称)。
(2)写出反应类型,B→C;C→D。
(3)X的分子式为:C10H13N2Cl,则X的结构简式为。
(4)设计步骤A→B的目的是:。
(5)写出同时满足下列条件的C的一种同分异构体的结构简式。
①苯的衍生物,含有两个互为对位的取代基;
②能发生水解反应,产物之一是甘氨酸,另一种产物能与FeCl3溶液发生显色反应;
③分子中有手性碳原子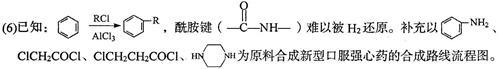

亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。
(2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。
(3)吸收塔内的温度不能过高的原因为:
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。
请写出pH≤2时ClO2与S2—反应的离子方程式: 。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。
(6)从滤液中得到NaClO2●3H2O粗晶体的操作步骤为
、 、 。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”、“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度/mol·L-1 |
(3)试确定K+是否存在?________,判断的理由是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
在CH3CH2Cl中滴加AgNO3溶液,现象为__________,原因是________________________________________________________________________。
若将CH3CH2Cl跟NaOH溶液共热,然后用HNO3酸化,再加入AgNO3溶液,现象为________________________________________________________________________,
反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。