(10分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g) 2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
(1)生成D的反应速率 。
(2)B的平衡浓度为 。
(3)A的转化率为 。
(4)该温度下的平衡常数K= 。
(5)如果增大反应体系的压强,则平衡体系中C的转化率 。(填“增大”或“减小”或“不变”)
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比是多少?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是_____________。
加热时,N2O5可按下列分解:N2O5 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3 N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)=mol/L,此时N2O5的分解率为。
N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)=mol/L,此时N2O5的分解率为。
(1)下列四种粒子中,半径按由大到小的排列顺序是 。
①基态X的原子结构示意图:○+16
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图: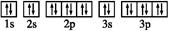
④W基态原子有2个能层,电子式:∶∶
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 ,离子半径由大到小的顺序是 ,原子序数由大到小的顺序是 。
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气) 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为;平衡时,气体的总物质的量是。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为。