亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:

(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中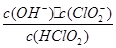 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
1965年合成了催化剂A,实现了温和条件下的烯烃加氢。
5-1 A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构。
5-2 A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):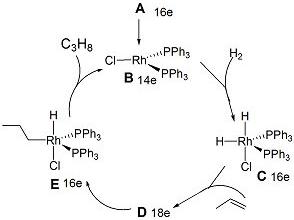
画出D的结构式。
5-3 确定图中所有配合物的中心原子的氧化态。
5-4 确定A、C、D和E的中心离子的杂化轨道类型。
5-5 用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由。
近年来,某些轻元素的含氢化合物及其复合体系作为氢源受到广泛关注。化合物A(XYH2)和B(XH)都是具有潜在应用价值的释氢材料。A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝。A和B混合可优化放氢性能。研究发现,该混合体系的放氢反应分三步进行:
2A =" C" + D⑴
D + B =" A" + H2⑵
C + B =" E" + H2⑶
将A和B按1∶2的摩尔(物质的量)比混合,在催化剂作用下,所含的氢全部以氢气放出,失重10.4%。
A、C、E均能水解生成F和D。G是由X和Y组成的二元化合物,其阴离子是二氧化碳的等电子体,G分解生成E和一种无色无味的气体I。写出A、B、C、D、E、F、G和I的化学式。
2-1 画出2,4-戊二酮的钠盐与Mn3+形成的电中性配合物的结构式(配体用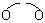 表示)。
表示)。
2-2 已知该配合物的磁矩为4.9玻尔磁子,配合物中Mn的未成对电子数为。
2-3 回答:该化合物有无手性?为什么?
2-4 画出2,4戊二酮负离子的结构简式(必须明确其共轭部分),写出其中离域π键的表示符号。
2-5 橙黄色固体配合物A的名称是三氯化六氨合钴(Ⅲ),是将二氯化钴、浓氨水、氯化铵和过氧化氢混合,以活性炭为催化剂合成的。机理研究发现,反应过程中首先得到Co(NH3)62+离子,随后发生配体取代反应,得到以新配体为桥键的双核离子B4+,接着发生桥键断裂,同时2个中心原子分别将1个电子传递到均裂后的新配体上,得到2个C2+离子,最后C2+离子在活性炭表面上发生配体取代反应,并与氯离子结合形成固体配合物A。写出合成配合物A的总反应方程式;画出B4+和C2+离子的结构式。
总反应方程式:
B4+和C2+离子的结构式:
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿(主要成份MnO2)制备高锰酸钾的流程图。
(1)软锰矿粉碎的目的。
软锰矿、KOH混合物在空气加热熔融反应生成K2MnO4的化学方程式为:
。操作Ⅲ的名称为。
(2)反应②的化学方程式为。
以上生产流程中可循环利用的物质是Ca(OH)2、CO2、、。
工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,电解K2MnO4溶液,阳极的电极反应式为。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性。简述实验操作、现象及相关结论:
。
有机玻璃(聚甲基丙烯酸甲酯)F,具有透光性好,质轻,耐水,耐酸、碱等性能。常用于制飞机,汽车,光学仪器,医疗器械等。它的一种合成路线如下图所示(部分产物已省略)。
(3)0.1mol的A 完全燃烧生成标准状况下的CO2 11.2 L ,把所得到的燃烧产物全部通过碱石灰,碱石灰增重31g。相同条件下,气态时A 的密度为N2密度的2.5倍。
请回答下列问题
①分别写出A、C的结构简式、。
用系统命名法命名A为。
②指出D→E的反应类型指出D中的含氧官能团名称③写出与E含有相同官能团,E的同分异构体,。
④写出C与银氨溶液反应的方程式。
⑤写出F→M的反应方程式。