某小组对Cu与浓HNO3的反应进行研究。记录如下:

I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:

①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有、。
Ⅱ.测定中和热的实验装置如下图所示。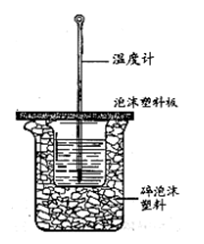
(3)大小烧杯之间填满碎泡沫塑料的作用是,从实验装置上看,图中缺少的一种玻璃仪器。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
| 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
℃ |
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②通过计算可得中和热△H= (精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),所求中和热(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会(填“偏大”、“偏小”、“不受影响”)。
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
II.【制备产品】
实验装置如图所示(省略夹持装置):
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是;E中的试剂是(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4。
(3)等Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
III.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,
,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是
。
(3)Na2S2O3·5H2O的溶液度随温度升高显著增大,所得产品通过方法提纯。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
所选试剂为。
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_______,其作用是_________ 。
(2)仪器D中盛放水,其作用是__________________________________________ 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称_______________________ 。
(4)所选用温度计G的量程表示正确的是________ 。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.50℃~100℃ |
(5)检验乙醛已制出的操作、现象是______________________________________ 。
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
试回答:
(1)A中发生的化学反应方程式为。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为;反应方程式为。
(4)写出G中反应的离子方程式。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因。
某学习小组用下图装置测定镁铝合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。
上述操作的顺序是___________(填序号);在进行操作③时记录C的液面位置时,除视线平视外,还应_。
(4)B中发生反应的化学方程式为_________________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“无影响”)。