①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是( )
| A.①②③均是氧化还原反应 |
| B.氧化性强弱顺序是 |
| C.反应②中氧化剂与还原剂的物质的量之比为6:1 |
| D.反应③中0.1mol还原剂共失去电子数为 |
在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是()
xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是()
| A.p3>p4,Y轴表示A的质量 | B.p3>p4,Y轴表示混合气体平均摩尔质量 |
| C.p3>p4,Y轴表示混合气体密度 | D.p3<p4,Y轴表示B的百分含量 |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是()
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
在一密闭的容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ()
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ()
| A.平衡向逆反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数增加了 | D.a > b |
关于下列各图的叙述,正确的是( )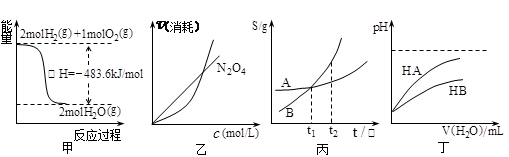
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
有关①100ml 0.1 mol/L  、②100ml 0.1 mol/L
、②100ml 0.1 mol/L 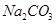 两种溶液的叙述不正确的是(
两种溶液的叙述不正确的是(
| A.①溶液中:c(CO32-)> c(H2CO3) | B.溶液中阴离子的物质的量浓度之和:②>① |
C.溶液中水电离出的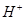 个数:②>① 个数:②>① |
D.②溶液中: c(HCO3-)> c(H2CO3) |