为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程式为: ,检验是否有Fe2+应选用下列 (选填序号)试剂。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
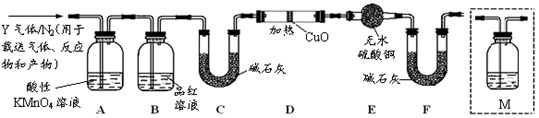
(3)装置B中试剂的作用是
(4)用化学方程式表示Y气体中的Q2气体是如何生成的 。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有 ,为制备纯净NaNO2作以下改进: 。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 (结果保留4位有效数字)。
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子反应方程式为:,中氧化剂与还原剂的物质的量之比为 。
硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀A是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。若沉淀B、C的质量均不为零,则生成B的离子方程式为: 。
(4)乙同学对甲同学的方案做了如下改进:
沉淀D为 ,与甲同学的方案相比,此方案的优点 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性 B.中性
C.碱性 D.可能酸性,也可能碱性
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
写出途径II的化学反应方程式: 。
若将Cu改为Zn,发现除得到SO2外还有得到一种气体,该气体可能为 。写出生成该气体的离子方程式 。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。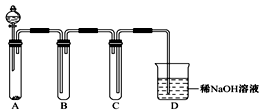
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。:
B的作用为: ;
C的作用为: ;
如要得到较为纯净的氯气可怎么改进该装置: 。
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。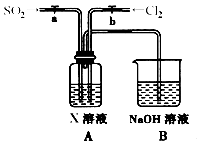
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若要证明SO2的漂白性,X为 ,操作为 ,现象为 。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。