定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的研究。请你一起踏上探究之路,回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝 ②高温灼烧CuO生成Cu2O和O2 ③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
方案1 取该红色固体加入适量稀H2SO4,实验现象为 ,结论为红色固体中含有Cu2O.
方案2 装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.
(1)为确保探究的科学、合理、安全.实验中还应采取的措施有 ;(填序号)
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程式
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg.
(1)该实验方案最少得进行 次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为 。
实验室制取氧气是同学们必须掌握的实验技能。请回答:
(1)E操作名称叫;
(2)小欣用上图BC装置制取氧气。
检查装置气密性:①先将B装置中导管浸入水中,然后双手紧握容器外壁
②先双手紧握容器外壁,然后将B装置中导管浸入水中
正确的是选择(填序号)。
实验过程中发生的化学反应式为;
如何判断C中氧气已收集满?(写出操作及现象)。
(3)小美用上图AD装置制取氧气。
实验数据的变化与以下四幅图像中的三幅相符,其化学反应式为____________,与此实验过程不相符的图像是 _____ (填序号)。
收集氧气的操作过程是:等集气瓶中的水排完后,一只手扶稳集气瓶,另一只手首先小心地将导管从瓶口移开,然后_________________________________,最后把集气瓶正放在桌子上。
万州中学初三一班的学生为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验,请你与他们一起完成以下探究活动。
【对固体猜想】Ⅰ:全部是NaOH;Ⅱ:全部是Na2CO3;Ⅲ:。
【查阅资料】经查阅资料可知,常见的盐溶液中,Na2CO3溶液显碱性,CaCl2溶液显中性
【实验和推断】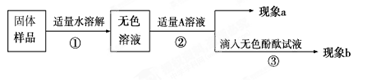
(1)向无色溶液中加入A溶液,现象a为有气泡产生,则A溶液是,说明氢氧化钠已经变质。
(2)由(1)可知氢氧化钠已经变质,重新取适量的无色溶液,加入足量的A(CaCl2溶液)除去Na2CO3,请写出这二者反应的化学方程式,当实验现象(提示:现象a和b),则猜想Ⅲ成立。
下图是实验室制取气体的一些装置,回答下列问题。(提示:以下所选装置均填装置序号) (8分)
(1)写出指定仪器的名称:① 。
(2)实验室用过氧化氢代替加热高锰酸钾制取氧气,其优点是节能、简便、环保等,请写出高锰酸钾制氧气的化学方程式。
(3)实验室利用大理石和稀盐酸用D装置制取二氧化碳,但是浪费了很多药品,老师发现后,要求节约药品,随时控制反应的发生和停止,则制取二氧化碳气体的发生装置是 ;某同学用碳酸钠和稀盐酸制取二氧化碳,请问他能否选择A或C装置(填:能或不能),如果要除去氧气和二氧化碳中混有的水蒸气,实验装置中一定要有上述装置。
(4)用氯酸钾制氧气的实验中,如果发现试管破裂,原因可能是,用排水法收集O2完毕后,停止实验时的操作顺序是,如果做氧气性质实验:铁在氧气中燃烧,那么用排水法收集O2时应在集气瓶中。
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小红同学设计实验对碳酸氢钠的性质进行了探究。请你参与她的探究活动。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体于试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。结论:①。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。
现象:②。反应的化学方程式为:③。
【探究实验3】碳酸氢钠的热稳定性。
【实验方案】设计实验装置如右图,并进行实验。
现象: 试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH。
(所选试剂不能用酸)
步骤:④;现象:⑤。
试写出碳酸氢钠受热发生反应的化学方程式:⑥。
【拓展应用】请说出碳酸氢钠在日常生活中的一种用途:⑦。
实验课上,老师给同学们提供了下列仪器以及大理石、氯酸钾、二氧化锰三种药品。
(1)写出仪器④的名称。
(2)利用老师提供的的仪器和药品可以制取氧气,写出相应反应的化学方式。检验制取的气体是否为氧气的方法是。
(3)若要制取一瓶二氧化碳气体。同学们还需向老师领取的药品是(填名称),制取二氧化碳时,上述仪器中一定不会用到的是(填序号)。