用化学符号表示:(4分)
(1)氖元素 ; (2)两个氢原子 ;
(3)两个钙离子 ; (4)氯离子 ;
(6分)我国是世界产煤大国。含硫煤燃烧排放的SO2会引起“酸雨”现象。
(1)燃煤释放的二氧化硫气体被飘尘吸附后在空气中发生氧化反应的化学方程式,在这个反应中飘尘起作用。
(2)为减少大气污染,某发电厂采用了“石灰固硫法”,即向煤中掺入熟石灰,用来吸收SO2,写出“固硫法”反应的化学方程式。
(3)为测定空气中SO2的含量,我们可以通过下面的原理来进行,即将SO2通入碘水(I2的水溶液),使之生成硫酸和氢碘酸(HI),变化过程可表示为: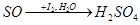
写出该反应的化学方程式。
(10分)完成下列变化的化学方程式,并按要求填空:
(1)少量硫酸铵固体与熟石灰混合研磨:;产生的气体可用试纸检验。
(2)铝壶内的水垢(主要成分是碳酸钙)不能长时间用稀盐浸泡的原因是:,其基本反应类型是。
(3)实验室加热高锰酸钾制取氧气:,在发生装置的试管口放一团棉花的作用是。
(4)某些工厂用稀硫酸清洗铁制品表面的铁锈(主要成分氧化铁):,溶液由无色变为色。
(5)硝酸银见光会分解,生成一种金属、红棕色气体(NO2)和能供给呼吸的气体:,所以,在实验室中硝酸银应保存在色瓶中。
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
【相关资料】(1)含水结晶盐受热时通常先失去结晶水;
(2)图2中物质B就是工业产品Mn3O4 ;
(3)Mn3O4在高温时会被氧化,且锰的化合价从+1到+7变化时逐级升高,如+2的锰先氧化到+3的锰,再从+3氧化到+4分别是对应的氧化物为三氧化二锰和二氧化锰。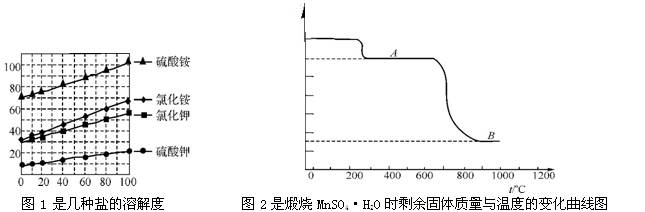
【问题解答】
(1)反应II中加入的NH4HCO3中氮元素的化合价为;
(2)反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、结晶、、洗涤、干燥等操作即得K2SO4晶体;
(3)试分析反应Ⅲ后有K2SO4析出的原因是____________________________;
(4)加热MnSO4·H2O固体时第一次质量减少的原因是(用化学方程式表示);
(5)煅烧过程中固体锰元素的质量分数随温度的升高而增大。但当温度超过1000℃时,再冷却后,测得产物中的锰元素的质量分数反而减小。试分析产物中锰元素的质量分数减小的原因:。
请结合下图回答有关问题: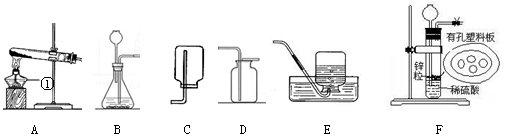
(1)写出有标号仪器的名称:①
(2)在所有装置中有一处明显错误,指出错误是,利用改正后的装置可用于实验室制取二氧化碳的装置组合(填字母)。
相对于B,装置F具有的优点是。
(3)工业上以氨气为原料制备硝酸的过程(见图1)如下: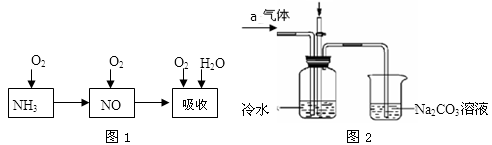
某课外小组认真分析了工业制取硝酸的流程及反应原理,设计了如图2的实验装置制备硝酸,试回答下列相关问题
①完成图1工业上用氨气制取NO的化学方程式是NH3 +O2 ═NO+H2O。
然后产生的NO被氧气氧化成NO2,NO2和水反应生成硝酸和NO。
②连接好图2该装置后,首先进行的操作,
③图2中通入的气体a是,其目是,
④盛有Na2CO3溶液的烧杯作为尾气处理装置有点缺陷,需在该装置导管口末端加一个倒扣漏斗,这样改进的优点是。
钢铁工业是国家工业的基础。下图是教材中炼铁高炉及炉内化学变化过程示意图。根据图示回答下列问题。
若图中采用的铁矿石的主要成分为氧化铁,请写出B区所发生主要反应的化学方程式:。
在B区中,焦炭首先燃烧放出热量提高炉温,继而焦炭和二氧化碳反应生成还原性的CO。
炉渣形成的过程是石灰石高温分解成的氧化钙与铁矿石中的二氧化硅化合成硅酸钙(CaSiO3),则形成炉渣的化学方程式为。