H2O2溶液发生分解反应:2H2O2 ="==" 2H2O + O2↑。在浓度相同的条件下,下列情况中氧气生成速率最大的是
| A.40℃,延长反应时间 | B.40℃,加少量MnO2 |
| C.80℃,加少量水 | D.80℃,加少量MnO2 |
可逆反应:3A(气)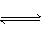 3B(?)+C(?)(正反应为吸热反应)随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应为吸热反应)随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
| A.B和C可能都是固体 |
| B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 |
| D.B和C可能都是气体 |
设C+CO2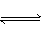 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2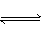 NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
| A.同时增大 |
| B.同时减小 |
| C.发v1增大,v2减小 |
| D.v1减小,v2增大 |
100mL6mol/L H2SO4跟过量锌粉反应,一定温度如下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A.碳酸钠固体 |
| B.醋酸钠固体 |
| C.硫酸钾溶液 |
| D.硫酸铵固体 |
反应4NH3(气)+5O2(气)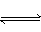 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A.v(NH3)=0.0100mol·L-1·s-1 |
| B.v(O3)=0.0010mol·L-1·s-1 |
| C.v(NO)=0.0010mol·L-1·s-1 |
| D.v(H2O)=0.045mol·L-1·s-1 |
反应2X(g)+Y(g) 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图10所示。下述判断正确的是( )。
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图10所示。下述判断正确的是( )。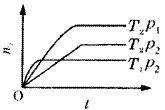
| A.T1<T2,p1<p2 |
| B.T1<T2,p1>p2 |
| C.T1>T2,p1>p2 |
| D.T1>T2,p1<p2 |