在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡一段时间后可见小球a 膨胀鼓起.下表中的各组物质不会出现上述现象的是() 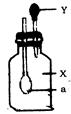
 |
X |
Y |
| A |
H2 |
Ca(OH)2 |
| B |
CO2 |
NaOH |
| C |
HCl |
Ba(OH)2 |
| D |
SO2 |
NaOH |
NA为阿伏加德罗常数,下列叙述正确的是()
| A.16 g氧气和16 g臭氧所含的原子数均为NA |
| B.常温常压下,11.2L氯气所含的原子数目为NA |
| C.2.3g钠由原子变成离子,失去的电子数为1.1NA |
| D.28g N2中所含的质子数目为7NA |
若4g CO2中含有N个分子,则阿伏加德罗常数是()
| A.11N/3 mol-1 | B.1/11N mol-1 | C.11Nmol-1 | D.3N/11 mol-1 |
某盐的混合物中仅含三种离子,其中0.45mol Mg2+,0.3mol Cl-,则SO42-的物质的量为()
| A.0.1mol | B.0.3mol | C.0. 5mol | D.0.7mol |
下列操作图示中错误的是()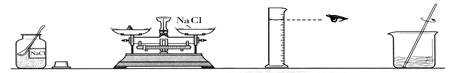
A B C D