15分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题: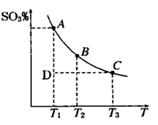
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)-c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
Cl2及其化合物在生产、生活中具有广泛的用途。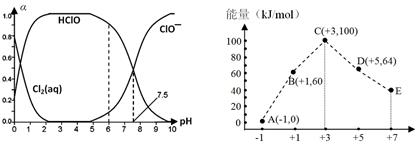
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是________________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为_________________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为_________________ ___。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)=___________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是 ;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为
【化学一一选修5:有机化学基础】
某药物可通过以下方法合成: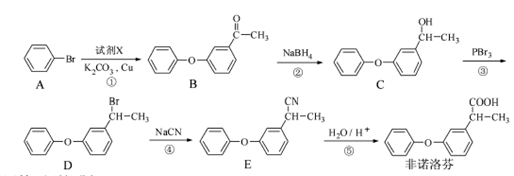
注:非诺洛芬是一种治疗类风湿性关节炎的药物。请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备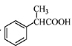 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
【化学——选修3:物质结构与性质】
金属铝、铁、铜与人类生产、生活息息相关。
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3-n)/2]m是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为
(2)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3A1F6的说法中正确的有__________(填正确答案标号);
a.三种物质中含有的化学键类型均有离子键和配位键
b.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有大量NH3分子
c.三种物质的组成元素中第一电离能最大的是氮元素
d.K4[Fe(CN)6]与Na3AIF6的中心离子具有相同的配位数
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因_____________,
(4)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上的Cl原子的杂化轨道类型为 _________________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为________________;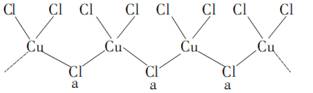
(5)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为 pm,阿伏加德罗常数的值为 (列式计算,结果保留三位有效数字)。
【化学——选修2:化学与技术】
正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。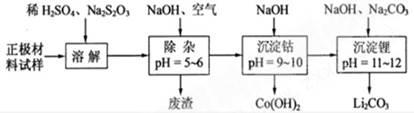
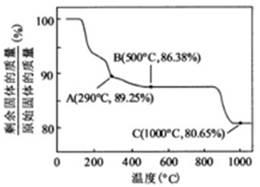
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 。
②Co(OH)2在空气中加热时,固体残留率随温度的变化, 如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(化学式)在350~400℃范围内,剩余固体的成分为 。(填化学式)。