常温下有五种溶液:①NaHCO3 ;②KNO3;③NH4HCO3;④KOH;⑤HCl
28.上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
上述①的水溶液呈碱性的原因是(用离子方程式表示) 。
29.取10mL 0.5mol/L⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.  ③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
30.②和④混合后撒入铝粉,有气体产生,该气体能使湿润的红色石蕊试纸变蓝。
写出该反应化学方程式:_______________________________________________________。
31.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O(l)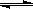 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。A.一定向正反应方向移动
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
32.如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化
B.通入大量稀有气体能提高反应的速率
C.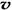 (N2)/
(N2)/ 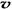 (O2)=2:3
(O2)=2:3
D.容器中气体的密度不随时间而变化
33.若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是。在A、B、C这三种分子中,属于非极
性分子的有(写化学式)。
(2)下列有关B的说法中正确的是。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是,其中心原子轨道的杂化类型
是。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g. 键 h.
键 h. 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100  ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是。步骤①中加入沸石的作用是。
(2)步骤②中采用油浴加热,下列说法正确的是。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后。
(5)步骤④有时需重复进行多次,其目的是。
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,

②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中 与
与 的体积
的体积
比为4:1): ,
,
(1) 550℃时,6.4 g 与足量
与足量 充分反应生成
充分反应生成 ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是。(填字母)
a.向平衡混合物中充入 b.向平衡混合物中充入
b.向平衡混合物中充入
c.改变反应的催化剂d.降低反应的温度
(3)为使 完全生成
完全生成 ,生产时要使用过量的
,生产时要使用过量的
空气,则当空气过量50%时,所得炉气中 的
的
体积分数是多少?
(4)720 g纯净的 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中 和
和 的物质的量之比n(
的物质的量之比n( ):n(
):n( )="6:"
)="6:"  ,
,
此时消耗空气为 mol。
mol。
①试写出易与口的关系式:。
②请在右图中画出 与
与 的关系曲线。
的关系曲线。
化合物 是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。
是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。 的
的
合成路线如下:
请回答下列问题:
(1)G中含有的含氧官能团的名称有。
(2)反应③为取代反应,D的结构简式是,D分子中含有种不同化
学环境的氢原子。
(3)同时符合下列a、b、c三个条件的B的同分异构体共有种。
a.能发生银镜反应;b.属于苯的衍生物,苯环上共有3个链状取代基;c.与
FeCl3溶液发生显色反应
(4)反应⑤的反应类型是。在反应①中,反应物的物质的量之比为1:l,
反应的化学方程式如下:

近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系
列火箭送入太空。
(1)长征二号捆绑式火箭推进剂以联氨( )作为燃料,
)作为燃料, 作为推进剂。
作为推进剂。
① 的主要作用是助燃,但其在工作时会产生红棕色气体
的主要作用是助燃,但其在工作时会产生红棕色气体 ,对环境会造
,对环境会造
成污染,为避免污染可使用下列(填字母)代替之。
| A.液态氨 | B. |
C. |
D.液态氧 |
②在碱性条件下,用尿素 和次氯酸钠反应可以制取联氨(产物中
和次氯酸钠反应可以制取联氨(产物中
同时有两种正盐),则该反应的离子方程式是。
(2)飞船座舱内空气的更新过程如下图所示:
①座舱内空气更新过程可以循环利用的物质为 、
、 和;装置Ⅱ中
和;装置Ⅱ中
发生反应的化学方程式为。
②从装置I、Ⅱ、Ⅲ可看出 的来源,若宇航员每天消耗35mol
的来源,若宇航员每天消耗35mol ,每天呼出
,每天呼出
的气体中含18 mol ,则呼出的气体中含
,则呼出的气体中含 mol.
mol.
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以 为例)、人工固氮(以
为例)、人工固氮(以 为
为
例)反应的平衡常数 的值如下表。
的值如下表。
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:



据报道,在常温、常压、光照、催化剂的条件下, 可以与水反应,则反应
可以与水反应,则反应 +
+ =
= +3/2
+3/2 的
的

(3)某研究小组在673 K、30 MPa下,在体积为 的
的
密闭容器中进行反应: ,
,
其 和
和 随时间变化的关系如图所示。
随时间变化的关系如图所示。
①下列叙述正确的是填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则 将增大
将增大
②从开始到平衡时反应的平均速率(以 的浓度变化表示)v(
的浓度变化表示)v( )= .
)= .
③若开始时 =
= ,则反应的平衡常数K=(用代数式表示).
,则反应的平衡常数K=(用代数式表示).