实验室制备乙酸乙酯的原理是:
CH3CH2OH+CH3COOH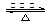 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
为了得到更多的乙酸乙酯常采用如下措施,
①原料选择无水乙醇和冰醋酸,而不是乙醇溶液或是醋酸溶液,其依据是____________ ;
②通过控制反应温度,尽可能地将生成的乙酸乙酯从反应体系中脱离,有利于乙酸乙酯的生成,其依据是__________ ;
防腐剂是指能防止由引起的腐败变质,以 食品保存期的食品添加剂。 是指以食品着色和改善食品色泽为目的的食品添加剂,按其来源和性质分为 和 。膨松剂根据组成成分的不同可分为 和 两类,碳酸氢钠能使食品膨松的原因用方程式表示为 。复合膨松剂一般由 、酸类(或酸性物质)和淀粉组成,淀粉的作用是 。一些对人体有害的化学物质禁止作为食品添加剂,例如 等(至少举出两例)。
在我国居民平衡膳食宝塔(每人每日摄入量) 中人体三大营养物质糖类主要来源于,蛋白质主要来源于 ,油脂主要来源于 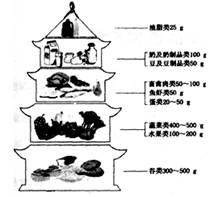
由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2中,所有原子是否都满足8电子结构?______________(填“是”或“否”)。
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2的一半。这一反应的化学方程式是___________________________________。
(3)浓盐酸在上述反应中显示出来的性质是_______________(填写编号)。
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
(4)若上述反应产生0.1molCl2,转移电子的物质的量为_______________mol。
(5)ClO2为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是Cl2的_____________倍。
(6)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是_______________________________。和欧洲的方法相比,我国这一方法的主要优点是_______________________________。
沱江特大污染事故,是近年来中国发生的最大一起水污染事故。是一起因四川化工股份有限公司技改项目违规试生产、青白江区政府有关领导和区环保局等部门对环保工作领导和监管不力酿成的特大责任事故。四川沱江特大污染给沿江生态环境及人民身体健康构成了严重的危害。
(1)2月份沱江污染是否是富营养化污染?为什么?
(2)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在消化细菌作用下将NH4+氧化为NO3- :NH4++O2—NO3-+H++H2O然后,加入甲醇与NO3-生成N2:
NO3-+5CH3OH—N2+CO2+H2O+OH-试配平以上两方程式。
(3)5月初的沱江二次污染主要是造纸厂超标排放污水所致。我国现有纸浆漂白主要是氯气漂白方法和次氯酸盐漂白法,这种方法排出的废水毒性大,废水量多,从而使我国制浆造纸工业纸浆漂白存在严重污染环境的问题。现世界各国正研究用绿色漂白剂取代传统的氯气,请写出你认为可作为研究方向的几种漂白剂:________。
如何减少室内污染:
(1)产生的主要原因:。
(2)CO的危害及原理:
防止CO中毒的方法:
(3)甲醛的危害:
(4)氡: