(本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗= ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| |
|
CO |
H2O |
CO2 |
CO |
|
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
5 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
650 |
2 |
1 |
A |
B |
t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
[化学─选修5:有机化学基础](15分)
(一)2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”。下图是大麻的主要成分THC的结构式。
(1)该物质含有的官能团的名称为,它的分子式为,分子中手性碳原子数为。
(2)下列关于THC的说法中正确的是
| A.分子中含有苯环,属于芳香烃类化合物 |
| B.难溶于水,易溶于乙醇、乙醚、苯和碱溶液 |
| C.可以发生加成反应、取代反应、氧化反应、消去反应 |
| D.除氢原子外,分子中所有的其它原子都在一个平面上 |
E.遇FeCl3溶液显紫色;可以使溴的四氯化碳溶液褪色
F.通常状态下,1mol该物质最多可与3mol Br2发生反应
(二)香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:
提示:2CH3CHO+(CH3CO)2O 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O
(1)A→B的化学方程式为。
(2)D的核磁共振氢谱图中的吸收峰有个。反应⑤的有机反应类型是反应。H的结构简式为。
(3)已知芳香族化合物I是G的同分异构体,且I的苯环上只有一个取代基。则I的结构简式可能为
。
[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是。
几种稀土元素的电离能(单位:kJ·mol-1)
| 元素 |
I1 |
I2 |
I3 |
I1+I2+I3 |
I4 |
| Sc(钪) |
633 |
1235 |
2389 |
4257 |
7019 |
| Y(钇) |
616 |
1181 |
1980 |
3777 |
5963 |
| La(镧) |
538 |
1067 |
1850 |
3455 |
4819 |
| Ce(铈) |
527 |
1047 |
1949 |
3523 |
3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为,1mol CH2=CH2中含有的σ键数目为。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为,列式表示Ce(铈)单质的密度:g·cm-3(不必计算出结果)
【化学——选修2化学与技术】(15分)
(一)下列叙述正确的是()
| A.合成氨的“造气”阶段会产生废气 |
| B.电镀的酸性废液用碱中和后就可以排放 |
| C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗 |
| D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染 |
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:。
(2)用碱液浸出产品比用热水更好,理由是。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。
为使除汞达到最佳效果,应控制条件是。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在;该电极pH将(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因。
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| Ksp |
2.2×10-20 |
4.0×10-38 |
8.0×10-16 |
1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为(用化学式表示)。
(2)实验室制备氨气的化学方程式为。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=,平衡时N2的转化率α(N2)=。若再增加氢气浓度,该反应的平衡常数将(填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(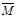 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。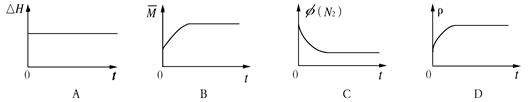
(14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3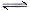 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是,该温度下H3PO3电离平衡的平衡常数K=。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为。
②产品室中生成亚磷酸的离子方程式为。