【化学-选修2:化学与技术】
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是___。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的是__________________________________________。
②混合溶液乙中溶质的化学式是_________________________________________________。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
(10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH="-113.0" kJ·mol-1
2NO2(g)ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
一定条件下,将NO2与SO2以体积比1: 2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
(1)已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为: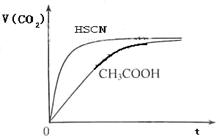
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,
反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,将pH=1的H2SO4溶液a mL与pH=12的NaOH溶液b mL混合后,所得溶液的pH=3,则a:b=;反应后,溶液中各离子浓度由大到小的顺序是。
(4分)(1)t℃时,测得纯水中c(OH-)=2×10-7mol·L-1, 则t25℃(填“>”、“<”或“=”),该温度下,水的离子积常数为;
(2)25℃时,某K2SO4溶液中c(SO42-)=1×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后的溶液中c(K+): c(H+)=;
(3)已知H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol;则反应1/2H2(g)+1/2Cl2(g)=HCl(g)的△H为
有pH=1的①盐酸②硫酸③醋酸
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为。
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为。
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为。
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值_____________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g)△H<0 CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g)△H<0 CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)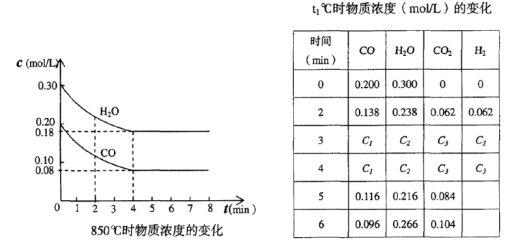
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度