某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 |
草酸的体积(mL) |
温度/℃ |
其他物质 |
| |
2 mL |
20 |
|
| |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| |
2 mL |
30 |
|
| ④ |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。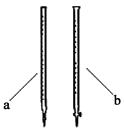
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
为测定某混合物中各组分的质量分数(已知该混合物含NaCl、Na2CO3•10H2O和NaHCO3),设计如下:
实验:
(1)加热前通入空气的目的是 ______________,操作方法为_______________________________。
(2)装置C中盛放的试剂可以是___________(填序号)。
a.碱石灰b.无水CaCl2c.P2O5d.固体NaOH
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将________(填“偏高”、“偏低”或“无影响”,下同);若撤去E装置,则测得Na2CO3•10H2O的含量。
(4)若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)
某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题: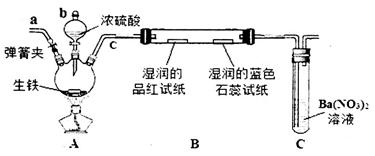
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为_____________:实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_____________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是________________________________。
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是___________________(用离子方程式表示)。
碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组的同学们为了确定某碱式碳酸镁的组成,设下图所示的实验装置。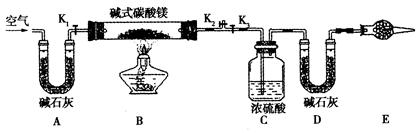
(1)实验步骤:
①按上图(夹持仪器未画出)组装好置后,首先进行的操作是________。E处干燥管盛放的药品是________________。
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管中;
称量:装浓硫酸的洗气瓶C的质量为m2g;装碱石灰的U形管D的质量为m3g
③打开活塞___________,关闭__________缓缓鼓入空气数分钟。
④关闭活塞_______,打开__________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4g;U形管D的质量为m5g。实验测得数据如下:m1 =" 31g" ,m2 ="87.6g" ,m3 = 74.7g,m4 =" 89.4g" ,m5 = 87.9g,计算推导:该碱式碳酸镁的化学式为_________________。
(2)关于该实验方案,以下说法你认为正确的是______________(填字母)
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)]的化学组成
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置
以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示:
| 苯甲酸 |
甲醇 |
苯甲酸甲酯 |
|
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)甲装置的作用是:;冷却水从 (填“a”或“b”)口进入。
(2)化学小组在实验中用过量的反应物甲醇,其理由是。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制
(1)试剂1可以是(填编号),作用是。
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在℃左右。
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为(结果保留三位有效数字)。
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是(填编号)。
A.蒸馏时从100℃开始收集产品
B.甲醇用量多了
C.制备粗品时苯甲酸被蒸出
(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2•yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
安静燃烧,火焰呈淡蓝色 |
气体成分为 ① |
| 实验Ⅲ |
将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② |
③ |
白色不溶物中含有MgCO3 |
| 实验Ⅳ |
取实验Ⅲ中的滤液,向其中加入适 量 ④稀溶液 |
产生白色沉淀,溶液红色变浅 |
溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示: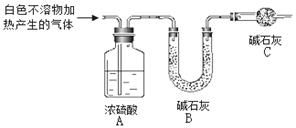
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是;
②白色不溶物的化学式为。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。