Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 (全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为
mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
(共10分)回答下列有关周期表的问题:
(1)在下图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式_____________________________________________________________
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示)
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式_____________________。
(共12分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。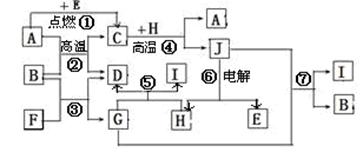
试回答下列有关问题:
(1)A在元素周期表的位置周期族。
(2)分别写出反应②⑦的化学方程式;。
(3)写出引发反应④的实验操作;
(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
。
(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:。
(9分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有__________________________。
(2)原混合物中肯定有____________________________。
(3)不能确定是否含有____________________________。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: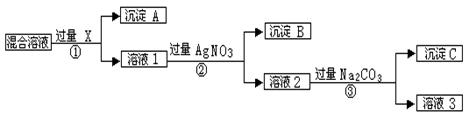
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X :沉淀A:沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质。
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2—甲基丙烷。完成下列填空:
1)A可以聚合,写出A的两种聚合产物________________、
2)A与某烷发生烷基化反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式_________________。
3)写出将A通入下列两种溶液后出现的现象。
A通入溴水:____________________________
A通入溴的四氯化碳溶液:_________________________
4)烯烃和NBS作用,烯烃中与双键碳相邻碳原子上的一个氢原子被溴原子取代。分子式为C4H8的烃和NBS作用,得到的一溴代烯烃有3种,分别写出其结构简式_______