电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: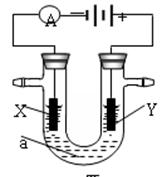
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池负极的电极反应为。
②工作一段时间后,测得溶液的pH(填增大、不变、减小)。
③用该电池作电源,组成如下图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为mL(标准状况),电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是(填写编号) 。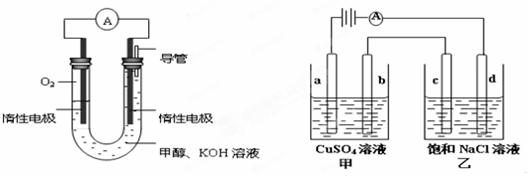
| A.CuO | B.CuCO3 | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子方程式为。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该反应的化学方程式:。工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置换反应,该反应的化学方程式是。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称),可以验证该结论的是(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方 程式为;
下列反应原理可以用于检查司机是否酒后开车。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反应中,氧化剂是。如果在反应中生成1molCr3+,转移电子数为。(用NA表示阿伏加德罗常数)
(2)写出上述化学方程式所缺项(填化学式)。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸点分别是78.5℃、34.5℃,分离二者混合物的方法是,乙醇比乙醚的沸点高的原因是 。
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是(只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。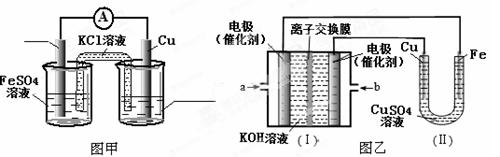
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入(填“CH4”或“O2”),b处电极上发生的电极反应式为;
若把II中电极均换为惰性电极,电解液换为含有0.1 mol NaCl溶液400 mL,当阳极产生的气体为448 mL(标准状况下)时,溶液的pH=(假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: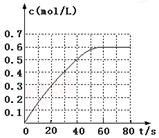
① 298k时,该反应的平衡常数为L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,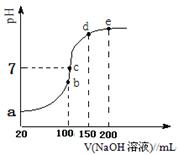
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序。
③d、e点对应溶液中,水电离程度大小关系是de(填“>”、“<”或“=”)。