(10分)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______________(选填序号),还缺少的仪器有________(写仪器名称)。
(2)配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体________mL(保留一位小数),量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是_________。
| A.容量瓶中原来含有少量蒸馏水 |
| B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容 |
| C.烧杯没有洗涤 |
| D.向容量瓶中加水定容时眼睛一直仰视刻度线 |
根据反应8NH3+3Cl2====6NH4Cl+N2回答下列问题。
(1)氧化剂_________,还原剂_________;
(2)反应中转移电子数是_________;
(3)氧化剂与氧化产物的质量比_________;
(4)当生成28gN2时,被氧化的物质的质量是_________g。
下列反应中氯元素全部被氧化的是____________,全部被还原的是____________,部分被氧化的是____________,既被氧化又被还原的是____________。
A.4HCl+MnO2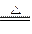 MnCl2+Cl2↑+H2O MnCl2+Cl2↑+H2O |
B.2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
| C.2KClO3====2KCl+3O2↑ | D.Cl2+H2O====HCl+HClO |
图所示的关系。
试回答下列问题:
(1)G的化学式为:。
(2)写出下列反应的化学方程式
①,
②。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质
的量与消耗盐酸的物质的量之比为3:8,则X的化学
式为:。
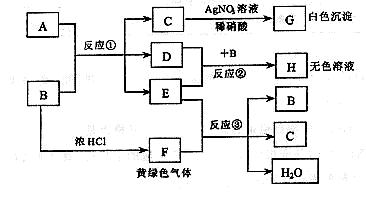
请回答:
(1) 依次写出A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________

(1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
⑵④号元素形成的气态氢化物的电子式为__________,属于_____分子(填极性或非极性)
⑶⑥、⑦两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________
⑷⑨号元素的原子结构示意图为_______________________。⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,它对环境的危害主要是: