茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 。
(6)称取400g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12g沉淀,原茶叶中钙元素的质量分数为 。
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题: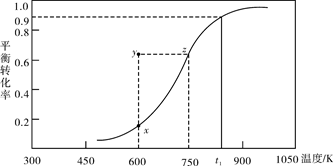
①600K时,Y点甲醇的υ(逆)(正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=;实验温度
T1T2(填“>”、“<”);催化剂的催化效率:实验①实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为;除去甲醇的离子方程式为。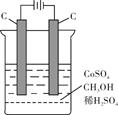
X、Y、Z、W四种常见元素,且均为短周期元素。已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为。
(2)Z的氧化物在通信领域用来作,工业上制Z单质的化学反应方程式为。
(3)在50mLlmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列实验方案进行探究。称量x g Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。欲计算W的质量分数。该实验中还需测定的数据是。 若用空气代替O2进行实验,对测定结果是否有影响?若有影响分析其原因。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是。
(2)操作Ⅰ是。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因。
(4)加入Sn粉的作用有两个:①调节溶液pH②。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中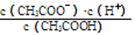 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: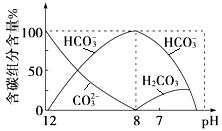
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、,溶液中含量最多的三种微粒的物质的量浓度的大小关系为;
(12分)许多尾气中含有NOx、S02等造成空气污染的气体。根据要求回答下列问题:
(1)已知:N02(g)+CO(g)≒C02(g)+NO(g)。
①密闭容器中发生该反应时,c(C02)随温度(T)变化曲线如图所示。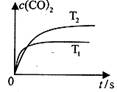
据此判断,升高温度,该反应的平衡常数(选填“增大”、“减小”、“不变”)。
②NO对臭氧层破坏的主要过程为: Ⅱ.NO+03→N02+02 Ⅲ.N02+O→NO+02
Ⅱ.NO+03→N02+02 Ⅲ.N02+O→NO+02
该过程中NO的作用为。
(2)将C02和H2合成二甲醚(cH30CH3)已取得了较大的进展,其化学反应为:
2C02(g)+6H2(g)≒CH30CH3(g)+3H20(g)
①1 mol二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时正极电极反应式。
(3)室温条件下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mo1.L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。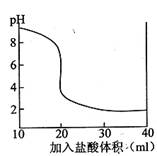
①该曲线表示滴定(填“NaOH”或“氨水”)的过程;
②当向20.00 mLNaOH溶液中加入V mL盐酸时,所得混合溶液pH=12,则v=。(保留2位小数)。