亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。
(1)亚磷酸是_______元酸。
(2)PCl3水解可制取亚磷酸:PCl3+3H2O=_________
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol∙L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol∙L-1。求该温度下上述电离平衡的平衡常数K=_______。(只考虑H3PO3的第一步电离,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH_____7(填“>”“=”“<”)
(4)亚磷酸具有还原性,可使碘水褪色。该反应的化学方程式为_______________。
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下: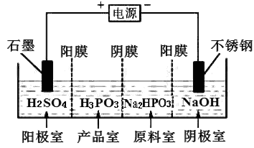
①阴极的电极反应式为__________。②产品室中反应的离子方程式为__________________。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ |
Ba2+ |
Al3+ |
| 阴离子 |
OH- |
Cl- |
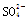 |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A__________,C__________,D__________,E__________。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是________。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: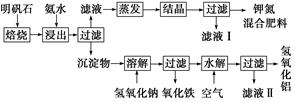
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、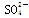 外,还有大量的
外,还有大量的 。检验
。检验 的方法是________________________________________________________________________
的方法是________________________________________________________________________
________________________________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
| 化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
∞ |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:______________、______________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是________________、________________。
Ⅱ.乙酸正丁酯精产品的制备
(1)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤,正确的操作步骤是__________(填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
(2)将酯层采用如下图所示装置蒸馏。
①写出上图中仪器A的名称______________,冷却水从__________口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在__________左右。
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成水的体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率为__________。
如图示的转化关系,已知C为密度最小的气体,甲是电解质。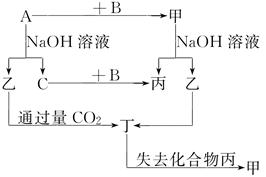
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________,B________,乙________,丁________。
(2)组成单质A的元素在周期表中的位置是________,丙的电子式是________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________。
②乙与过量CO2反应的离子方程式________________________________________________________________________
________________________________________________________________________。
如图在试管甲中先加入2 mL 95%的乙醇,并在振荡下缓慢加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸钠(CH3COONa)。将试管甲固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按图连接好装置进行实验,当试管乙中有明显现象时停止实验。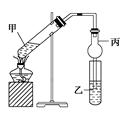
试回答:
(1)实验时,应对试管甲缓慢加热,其目的是________________________________________________________________________
________________________________________________________________________。
(2)写出试管甲中发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)加入浓硫酸的作用是____________、____________、____________。
(4)该实验中球形管丙的作用是____________________________________。
(5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因:____________________。