偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.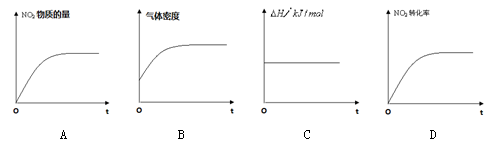
若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
②Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
(本题共8分)实验对认识和研究物质性质有重要作用,回答下列相应问题。
(一)为证明Na2SiO3具有防火性能,同时做以下两个实验。
实验①:取一小木条,放入蒸馏水中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,放置在酒精灯外焰处。
实验②:另取一个相同的小木条,放入Na2SiO3饱和溶液中,之后重复实验①的操作。
(1)设计实验①的目的是 。
(二)性质实验中反应原理常用化学方程式表示。请用化学方程式各举一例,说明下列物质所具有的性质。
(2)SO2具有还原性 。
(3)SO2具有酸性氧化物共同的性质 。
(4)浓硫酸具有强氧化性 。
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
拆开1mol共价键所需吸收的能量如下表:
| 共价键 |
H—H |
N三N |
N—H |
| 吸收的能量/kJ |
436 |
946 |
391 |
(1) 1mol N2完全反应为NH3(填:吸收或放出)kJ能量
(2)事实上,将1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是
阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是(填序号).
| A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶
于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向
滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向
滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为。