(14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。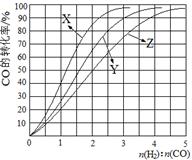
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
(1)写出“氧化”过程中生成Na2FeO4的化学方程式 。
(2)“转化”过程中发生的化学反应方程式为 。
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=" _____" (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ___ 573K(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是。
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
常温下有浓度均为0.5mol・L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。该物质水解的离子方程式为 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
(1)通常状况下,已知X、Y两种气体,其质量分别为a、b时,体积之比为2:3。 两种气体X、Y的相对分子质量之比为________;相同条件下的X、Y两种气体,体积相同时,则X、Y的密度之比为__________;相同条件下,同质量的两种气体,X与Y的分子数之比为________。
(2)已知下列反应能发生:
2A3+ + 2B - = 2A2+ + B2;
C2 + 2B- = 2C- + B2;
2A2+ + C2 = 2A3++ 2C-
上述三个反应中氧化剂的氧化性强弱顺序为___________;还原剂的还原性强弱顺序为___________。
(3)一定条件下硝酸铵受热分解的化学方程式为: NH4NO3→HNO3+N2↑+H2O(未配平),写出配平后的化学方程式:________________________。在反应中被氧化与被还原的氮原子数之比为
(4)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是()
| A.野火烧不尽,春风吹又生 |
| B.春蚕到死丝方尽,蜡炬成灰泪始干 |
| C.粉身碎骨浑不怕,要留清白在人间 |
| D.爆竹声中一岁除,春风送暖入屠苏 |
水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________
用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸220ml。试回答下列问题:
(1)浓盐酸的物质的量浓度为 ;
(2)经计算,在量取浓盐酸时宜选用下列量筒中的 (填序号)。
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近刻度线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是( )
A.①②③④ B. ③④①②
C.④①②③ D.③①④②
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。