某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示: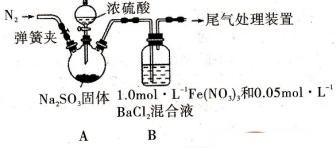
已知:l.0mol·L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:……
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】猜想1成立。其结论正确吗? (填是或否)。
若不正确,理由是________(正确无需回答)。
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ①配溶液____________________。 ②…… |
|
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程 、 。
已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
限选的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
(一)初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验可以得到的初步结论是
。
(二)进一步探究
(2)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
| 实验操作 |
预期现象和结论 |
(10分)化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。
 试回答下列问题:
试回答下列问题: (1)请你完成装置改进的措施和理由:
(1)请你完成装置改进的措施和理由: ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 理由_______________________________________。
理由_______________________________________。 ②措施: ________________________,
②措施: ________________________, 理由______________________________________。
理由______________________________________。 (2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是 _______________________ (用化学方程式表示)。
_______________________ (用化学方程式表示)。 任何的推论都要经过检验,请完成对白色固体成分的探究:
任何的推论都要经过检验,请完成对白色固体成分的探究: 限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
① 提出合理假设:
提出合理假设: 假设1:白色固体为Na2SO3;假设2:白色固体为Na2SO3与Na2SO4的混合物;
假设1:白色固体为Na2SO3;假设2:白色固体为Na2SO3与Na2SO4的混合物; 假设3: 。
假设3: 。
② 设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| … |
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 |
|||
| 质量/g |
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度___ __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是3→ (填各导管口编号)。
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如图所示。请将读数填到表格的相应位置
| 滴定前读读数/mL |
滴定后读数/mL |
|
| 第一次 |
||
| 第二次 |
0.10 |
18.00 |
| 第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为mol。
(3)气体成份分析
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程(填“有”或“没有”)NO产生,作此判断的依据是。
可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。


A BC
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择(填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为nmol,则用含n和V的式子表示m=(结果可不必化简)。