(1)已知:Fe(s)+ O2(g)=FeO(s) △H=-272.0kJ•mol-1
O2(g)=FeO(s) △H=-272.0kJ•mol-1
2Al(s)+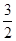 O2(g)=Al2O3(s) △H=-1675.7kJ•mol-1
O2(g)=Al2O3(s) △H=-1675.7kJ•mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
与前一方案相比较,该方案的优点是_________________________________。
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下: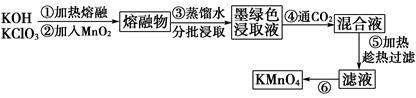
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO42-发生反应,生成MnO4-和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
综合利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]和硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: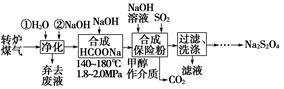
(1)转炉炼钢时,存在反应:Fe3C(s)+CO2(g)2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H2O2均可用于纸浆漂白,写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________________________________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平;②烧杯;③量筒;④玻璃棒;⑤容量瓶;⑥胶头滴管;⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
按如图所示装置连接,X、Y均为惰性电极。请回答下列问题: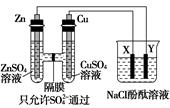
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是___________。
(3)图中通过隔膜的SO42-向________(填“左”“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。