对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K= ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 |
电离方程式 |
电离平衡常数K |
| CH3COOH |
CH3COOH H++CH3COO- |
1.75×10-5 |
| H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1=4.4×10-7 K2=4.7×10-11 |
| H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值________(填“变大”、“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性相对强弱的关系是_____________________________________________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是________,酸性最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,总有: ,产生此现象的原因是________________________________________________________________________。
71gNa2SO4含有SO42-________mol,含有O原子___________个,含有S原子______g;完全溶于水,配成2 L溶液,则所得溶液中Na+的物质的量浓度为___________。
室安卡因(G)是一种抗心率天常药物,可由下列路线合成;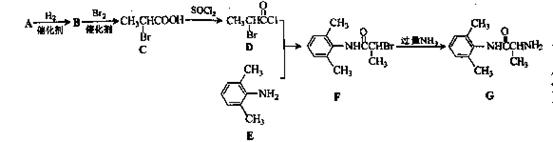 (1)已知A是
(1)已知A是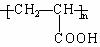 的单体,则A中含有的官能团是(写名称)。B的结构简式是。
的单体,则A中含有的官能团是(写名称)。B的结构简式是。
(2)C的名称(系统命名)是,C与足量NaOH醇溶液共热时反应的化学方程式是。
(3)X是E的同分异构题,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有种
(4)F→G的反应类型是。
(5)下列关于室安卡因(G)的说法正确的是。
a.能发生加成反应b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐d..属于氨基酸
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。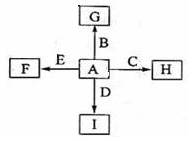
回答问题:
⑴①中反应的化学方程式为;
⑵化合物I的电子式为,它的空间结构是;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少所需的铜粉的质量为,
⑷C与过量NaOH溶液反应的离子方程为,反应后的溶液与过量化合物I反应的离子方程式为;
⑸E在I中燃烧观察到的现象是。
⑹G的化学式是。
高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于
日常生活用水 和工业废水的处理。
和工业废水的处理。
(1)为检测PAFC中Al和Fe含量,采用如图所示流程进行。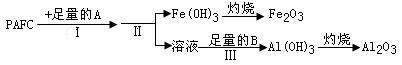
回答下 列问题:
列问题:
①PAFC中铁元素的化合价为_________。
②步骤I中的试剂A是_________(填“氨水”或“氢氧化钠溶液”)。
③步骤Ⅱ的名称是。
④步骤Ⅲ的离子方程式为___________________________________。
(2)某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:
①所得酸性溶液中,不能确定是否一定存在的阳离子是___________
A、Al3+B、Fe2+C、Fe3+D、H+
为证明该离子确实存在,可采用的试剂是_____________________。
②往酸性 溶液中加入试剂X的目的是_________________________________。
溶液中加入试剂X的目的是_________________________________。
(3分)1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于_______