已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
| A.Q2<Q1<197 kJ·mol-1 | B.2Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.2Q2=Q1<197 kJ·mol-1 |
某无色溶液中含有:①Na+、②Ba2+、③C1—、④Br—、⑤SO 、⑥SO
、⑥SO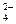 离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| ① |
用pH试纸检验 |
溶液的pH大于7 |
| ② |
向溶液中滴中氯水,再加入CC14振荡,静置 |
CC14层呈橙色 |
| ③ |
向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| ④ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
| A.肯定含有离子的①④⑤ |
| B.肯定没有的离子是②⑤ |
| C.可能含有的离子是①②⑥ |
| D.不能确定的离子是①③⑥ |
将一定质量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448 mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止容器剩有铜粉m2g,则(m1—m2)为
| A.5.76 | B.2.88 |
| C.1.92 | D.0 |
膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如右图所示。下列有关芥子醇的说法正确的是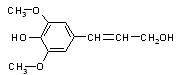
| A.芥子醇的分子式是C11H14O4,属于芳香烃 |
| B.芥子醇分子中所有碳原子不可能在同一平面 |
| C.芥子醇不能使酸性KMnO4溶液褪色 |
D.芥子醇可以发生氧化反应 、取代反应、加成 、取代反应、加成 反应 反应 |
下列说法正确的是
A.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3·H2O、④CH3COONH4溶液中c(NH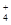 )由大到小的顺序是:②>①>④>③
)由大到小的顺序是:②>①>④>③
B.常温下0.4 mol/L HB溶液和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中离子浓度大小顺序为:c(HB)>c(Na+)>c(B—)>c(H+)>c(OH—)
C.pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,相同温度时,四种溶液中由水电离的c(H+)相等
D.用惰性电极电解足量的CuSO4溶液一段时间,加入一定量的Cu(OH)2可以恢复至原来的浓度和体积
一定条件下,在体积为10 L的密闭容器 中,1 mol X和1 mol Y进行反应:
中,1 mol X和1 mol Y进行反应:
2X(g) +Y(g)  Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·S) |
| B.将容器体积变为20 L,Z的平衡浓度为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |