化学工作者从有机反应:RH+Cl2(g)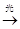 RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.其中“g”代表气态,“l”代表液态,试指出从上述反应产物中分离得到盐酸的最佳方法是
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.其中“g”代表气态,“l”代表液态,试指出从上述反应产物中分离得到盐酸的最佳方法是
| A.蒸馏法 | B.水洗分液法 | C.升华法 | D.有机溶剂萃取法 |
六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子稳定结构,则该分子中含有的共价键的数目是()
| A.10 | B.12 | C.24 | D.28 |
有关乙炔分子中的化学键描述不正确的是()
| A.两个碳原子采用sp杂化方式 |
| B.两个碳原子采用sp2杂化方式 |
| C.每个碳原子都有两个未杂化的2p轨道形成π键 |
| D.两个碳原子形成两个π键 |
DNA分子的两条链之间通过氢键结合。DNA分子复制前首先将双链解开,则DNA分子复制将双链解开的过程可视为()
| A.化学变化 | B.物理变化 |
| C.既有物理变化又有化学变化 | D.是一种特殊的生物变化 |
下列物质中分子间能形成氢键的是()
| A.N2 | B.HBr | C.NH3 | D.H2S |
沸腾时只需克服范德华力的液体物质是()
| A.水 | B.酒精 | C.溴 | D.水银 |