已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A ,E ,戊 。
(2)F转化为C的过程中出现的现象是: 。
(3)写出②中反应的离子方程式: 。
(4)①~⑥转化中不含有氧化还原反应的是: (填序号)。
市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于方框内)
□ KIO3 + □KI + □H2SO4 = □K2SO4 + □I2 + □H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是:________________________________;
②b中反应所产生的I2的物质的量是:mol;
A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C 相邻,C的最外层电子数是其电子总数的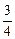 ,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中,沸点最高的是(用化学式表示,下同)_____________,稳定性由强到弱的顺序是___________________________________。
(2)若由A、B、C、D四种元素组成一种离子化合物,1 mol该化合物中含有10 mol原子,则该化合物受热分解的化学方程式为:___________ 。
若由A、B、 C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的结构式:___________________________________。
(3)Y跟HCl反应生成固体。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2被完全破坏,当有1 mol NaNO2发生反应时,共有3 mol电子转移,该反应的化学方程式为_________________________。
2010年8月7日甘肃舟曲发生特大泥石流灾害,专家指出,为防止大灾过后瘟疫发生,可用含氯消毒剂和过氧化物对环境消毒。
(1)气体二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只作氧化剂的是 (填序号)。
| A.MnO2 | B.KMn O4溶液 O4溶液 |
C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
(4)物质的标准生成热是指由稳定的单质生成1mol指定物质时的热效应。如H2O(l)的生成热为-285.8 kJ·mol-1,用热化学方程式表示为 H2(g)+1/2O2(g)=H2O(l);△H= -285.8 kJ·mol-1。查表知ClO2的标准生成热是+102.5kJ·mol-1,则该反应用热化学方程式表示为________________________________。
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题
(1)若两池中均为CuSO4溶液,反应一段时间后
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是________________________。
(2)若两池中均为饱和NaCl溶液
①写出乙池中总反应的离子方程式______________________。
②甲池中碳极上电极反应式是________________________,乙池碳极上电极反应属于_____________________ (填氧化反应、还原反应)。
③将湿润的淀粉KI试纸放在乙池碳 极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为
极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为
5:1,且生成两种酸,该反应的化学方程式为________________________。
④若乙池转移0.02mole-后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=____________
(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试 纸检验Cl2的性质;
纸检验Cl2的性质;
②分液漏斗(分液);
(2)下列有关实验的叙述中,合理的是(多选倒扣分)
| A.用碱式滴定管量取25.00mL溴水 |
| B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
(3)卤素单质F2、Cl2、Br2、I2的熔沸点由高到低排列为,理由是;
卤化氢HF、HCl、HBr、HI中,沸点最低为,最高为,造成的原因为。