短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Y、Z、W形成的某种化合物晶体类型是 (填“晶体类型”名称)。
(5)X和Y形成的化合物沸点比X和W形成的化合物沸点 (填“高”或“低”)。
(6)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
油脂是重要的营养物质。某天然油脂A可发生下列反应: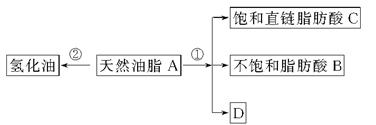
已知:A的分子式为C57H106O6。1 mol该天然油脂A经反应①可得到1 mol D、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:________。
(2)写出反应①的反应类型:________;C的名称(或俗称)是________。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是________。
a.氢化油又称人造奶油,通常又叫硬化油
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂
d.油脂的氢化与油脂的皂化都属于加成反应。
(4)D和足量金属钠反应的化学方程式:_________________________。
如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为________。
(4)图中长玻璃导管的作用为__________________________________。
(5)写出该反应的化学方程式:________________________________。
一种有机物的结构简式为:
试回答下列问题:
(1)该化合物的种类是________。
A.烯烃 B.酯 C.油脂 D.高分子化合物
(2)该化合物的密度________。
A.比水大 B.比水小
(3)该化合物常温下的状态为________。
A.液体 B.固体 C.气体
(4)与该物质能反应的有________。
A.NaOH溶液 B.碘水
C.乙醇 D.乙酸 E.H2
写出该有机物与选出的化合物反应的化学方程式(任写一个):________。
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母菌和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。
回答下列问题:
(1)A的化学名称为________;
(2)由B生成C的化学反应方程式为________,该反应的类型为________;
(3)D的结构简式为________;
(4)F的分子式为________;
(5)G的结构简式为________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有________种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是________(写结构简式)。
A、B、C、D、E均为有机物,它们具有下图的转化关系:
已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称:________,E中含有的官能团(写结构简式)________、________;写出有机物B可能发生的两种反应类型:_______________________;
(2)写出反应②的化学方程式:_____________________________________;
该反应需加热的目的是___________________________________________;
(3)A的结构简式为________。