砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。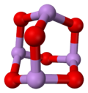
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 |
E.配位键 F.金属键
G.极性键
写出下列各粒子的化学式
(1)由2个原子组成的具有10个电子的分子阴离子是
(2)由4个原子组成的具有10个电子的分子是阳离子是
(3)由3个原子组成的具有18个电子分子是
(4)由5个原子组成的具有10个电子的阳离子是。
在周期表中氧化性最强的一族元素是,它们原子最外层上的电子数目都是。
该族元素氢化物的通式是,最高价氧化物的通式是。该族元素氢化物的水溶液显,最高价氧化物的水化物显。该族元素随核电荷数的递增,原子半径逐渐,氧化性逐渐。
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+中只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中氢化物最稳定;Z的原子核内质子数是Y的最外层电子
数的2倍;F与Z同主族;E与X同主族。试推断:
⑴下列元素分别是:Y ZF。(用元素符号表示)
⑵X、Z、E形成化合物的电子式为,所含有的化学键有
;它属于化合物(填离子或共价)
非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题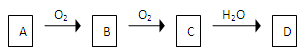
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是。
②在工业生产中,大量排放的B气体被雨水吸收后形成而污染环境
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是;。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
。
该反应(填属于或不属于)氧化还原反应。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。