工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)△H="a" kJ/mol,在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g)△H="a" kJ/mol,在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
下列说法不正确的是
| A.10 min内,T1时CH4的化学反应速率比T2时小 |
| B.T1<T2 |
| C.平衡常数:K(T1)<K(T2) |
| D.a<0 |
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)  W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是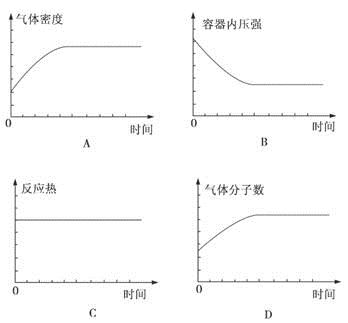
下列说法中可以证明反应H2(g)+I2(g)  2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI) ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,生成物浓度不再变化 ⑦温度和体积一定时,容器内的压强不再变化 ⑧条件一定时,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
| A.①②③④ | B.②⑥⑨ | C.②⑥⑨⑩ | D.③⑤⑥⑦⑧ |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
| A.2v(NH3)=v(CO2) |
| B.密闭容器中c(NH3)∶c(CO2)=2∶1 |
| C.密闭容器中混合气体的密度不变 |
| D.密闭容器中氨气的体积分数不变 |
在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是
| A.该反应的焓变和熵变:ΔH>0,ΔS<0 |
| B.温度降低,该反应的平衡常数K增大 |
| C.升高温度,n(CH3OH)/n(CO2)增大 |
| D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min) |